
【题目】计算下列各数值。
(1)3.1g Na2X含有Na+ 为0.1mol,则Na2X的摩尔质量为__,X的相对原子质量为__。
(2)8.5g氢氧根离子含有的电子数目为_______。
(3)14g C2H4与C4H8的混合物所含质子的物质的量为__。
(4)1.43g Na2CO3·10H2O溶于水配成100mL溶液,则c(Na2CO3)为__mol/L;取20mL该溶液,加入__mL水得到0.004mol/L的Na2CO3溶液(设稀释时对溶液体积的影响忽略不计)。
【答案】62 g/mol165 NA8 mol0.05 mol/L230 mL
【解析】
(1). 3.1g Na2X含有Na+ 为0.1mol,由Na2X的化学式可知,Na2X的物质的量为0.05mol,则Na2X的摩尔质量为:M(Na2X)=![]() =62g/mol,Na2X的相对分子质量为62,所以X的相对原子质量为62-2×23=16,故答案为:62g/mol;16;
=62g/mol,Na2X的相对分子质量为62,所以X的相对原子质量为62-2×23=16,故答案为:62g/mol;16;
(2).8.5g氢氧根离子的物质的量为:n(OH-)=![]() =0.5mol,1个OH-含有10个电子,则8.5g氢氧根离子含有的电子数目为0.5mol×10×NA=5 NA,故答案为:5 NA;
=0.5mol,1个OH-含有10个电子,则8.5g氢氧根离子含有的电子数目为0.5mol×10×NA=5 NA,故答案为:5 NA;
(3). C2H4与C4H8的最简式均为CH2,则14g CH2的物质的量为14g÷14g/mol=1mol,1个CH2中含有8个质子,所以质子的物质的量为8mol,故答案为:8mol;
(4). 1.43g Na2CO3·10H2O的物质的量为1.43g÷286g/mol=0.005mol,溶于水配成100mL的溶液,c(Na2CO3)=0.005mol÷0.1L=0.05mol/L;取20mL该溶液,设加入a mL水得到0.004mol/L的Na2CO3溶液,根据稀释定律有:0.02L×0.05mol/L=(20+a)×10-3L×0.004mol/L,解得a=230mL,故答案为:0.05mol/L;230mL。


科目:高中化学 来源: 题型:
【题目】已知:氮化铝(AlN)溶于强酸产生铝盐,溶于强碱生成氨气。
(1)AlN与NaOH溶液反应的化学方程为_______。
(2)甲同学通过测定AlN与NaOH溶液反应产生氨气的质量来测定AlN的纯度(假设杂质不参与反应,忽略NH3在强碱性溶液中的溶解)。实验装置如下:

①选择上图中合适的装置,其连接顺序为______(按气流从左到右方向,填字母)。
②装置A中干燥管的作用是________。
(3)乙同学通过测定氨气体积来测定AlN的纯度。

①导管a的作用是________。
②读数前,需要进行的操作是_______。
③若称取样品的质量为mg,量气管中测定的气体体积为VmL,该实验条件下的气体摩尔体积为VmL/mol,则AlN的质量分数为______;若读取量气管中气体的体积时,液面左高右低,则测得的AlN的纯度______(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Fe2(SO4)3溶液中,含SO42-为11.52g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中Fe3+的物质的量浓度约为
A. 0.1 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下的密闭容器中:4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是( )
4NO(g)+6H2O(g) ΔH=-905.9 kJ·mol-1,下列叙述正确的是( )
A. 4 mol NH3和5 mol O2反应,达到平衡时放出热量为905.9 kJ
B. 平衡后升高温度,混合气体中NO含量降低
C. 平衡后降低压强,混合气体平均摩尔质量增大
D. 平衡时v正(O2)=4/5v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如下图所示实验装置,回答下列问题。

(1)写出下列仪器的名称:
①_____________, ②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少 的仪器是_____________,将仪器补充完整后进行的实验操作的名称为________;②的进水口是______(填“f”或“g”)。实验中,仪器①中需加入沸石,其作用为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示在不同条件下的酶促反应速率变化曲线。据图分析叙述错误的是( )
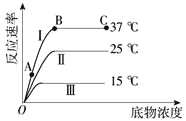
A. 影响AB段反应速率的主要因素是底物浓度
B. 影响BC段反应速率的主要限制因素可能是酶量
C. 温度导致了曲线Ⅰ和Ⅱ的反应速率不同
D. 曲线Ⅰ显示,该酶促反应的最适温度为37 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯原子的质量是a g,12C原子的质量是b g,用NA表示阿伏加德罗常数的值,下列说法中正确的是
①该氯原子的相对原子质量为12a/b
②该氯原子的摩尔质量是aNA g
③m g该氯原子的物质的量为m/(aNA)mol
④a g该氯原子所含的电子数为17 mol
A. ①③ B. ②④ C. ①② D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com