
【题目】300mL Fe2(SO4)3溶液中,含SO42-为11.52g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中Fe3+的物质的量浓度约为
A. 0.1 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L
科目:高中化学 来源: 题型:
【题目】下列关于化学键的说法正确的是
A. 构成单质分子的微粒一定含有共价键
B. 不同元素组成的多原子分子里的化学键一定都是极性键
C. 非极性键只存在于双原子单质分子中
D. 全部由非金属元素组成的化合物不一定是共价化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物M 是一种局部麻醉药,实验室由芳香烃A 合成M的一种路线如下:
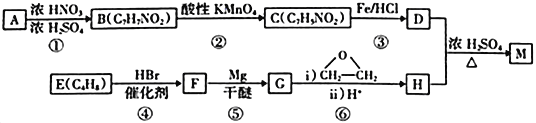
已知: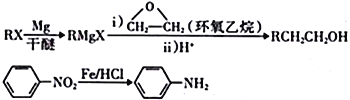
回答下列问题:
(1)A的化学名称为______________,F中所含的官能团为____________。
(2)③的反应类型是____________,④的反应类型是_____________。
(3)B的苯环上有2种化学环境的氢原子,D在一定条件下发生缩聚反应生成的高分子产物的结构简式为_______________________。
(4)F的核磁共振氢谱只有1组吸收峰,D和H生成M的化学方程式为__________________________。
(5)L是H的同分异构体,L不能与金属钠反应,核磁共振氢谱只有两组峰,且峰面积比为6∶1,L的结构简式为__________________________。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛[OHC(CH2)4CHO],设计合成路线______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水得到的粗食盐水中常含Ca2+、Mg2+、SO42-,需要分离提纯。现有含少量CaCl2、MgSO4的粗食盐水,在除去悬浮物和泥沙之后,要用4种试剂:①盐酸、②Na2CO3、③NaOH、④BaCl2来除去食盐水中的Ca2+、Mg2+、SO42-。提纯时的操作步骤和加入试剂的情况如图。

图中a、b、c、d分别表示上述4种试剂中的一种,请回答:
(1)沉淀A的名称是________。
(2)试剂d是________;判断试剂d已经足量的方法是__________________________。
(3)加入b、c后溶液中发生的化学反应的化学方程式有______________________(任写两个)。
(4)现有下列仪器,过滤出沉淀A、B、C时必须用到的是____(填序号),仪器③的名称是_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数,下列叙述正确的是
A. 11 g由![]() 和
和![]() 组成的超重水中,含有的中子数目为5NA
组成的超重水中,含有的中子数目为5NA
B. 常温下,1.0 LpH=13的Ba(OH)2溶液中含有的OH-数目为0.1 NA
C. 标准状况下.11.2 L乙烯中含有共用电子对的数目为NA
D. 常温下.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程,属于物理变化的是( )
A. 煤通过干馏制取焦炭 B. 石油通过分馏得到汽油
C. 煤通过气化和液化制取清洁燃料 D. 石油通过催化重整获得芳香烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】计算下列各数值。
(1)3.1g Na2X含有Na+ 为0.1mol,则Na2X的摩尔质量为__,X的相对原子质量为__。
(2)8.5g氢氧根离子含有的电子数目为_______。
(3)14g C2H4与C4H8的混合物所含质子的物质的量为__。
(4)1.43g Na2CO3·10H2O溶于水配成100mL溶液,则c(Na2CO3)为__mol/L;取20mL该溶液,加入__mL水得到0.004mol/L的Na2CO3溶液(设稀释时对溶液体积的影响忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
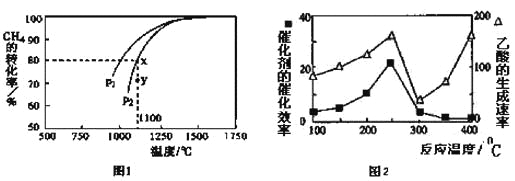
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家预言,燃料电池将是21世纪获得电能的重要途径。近几年开发的甲醇燃料电池是采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:

请回答下列问题:
(1)Pt(a)电极是电池的________极,电极反应式为__________________;Pt(b)电极发生________(填“氧化”或“还原”)反应,电极反应式为___________。
(2)电池的总反应方程式为____________________。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com