
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成CH4。
写出CO与H2反应生成CH4和H2O的热化学方程式
已知: CO(g)+H2O(g)![]() H2(g)+CO2(g) ΔH=-41kJ·mol-1
H2(g)+CO2(g) ΔH=-41kJ·mol-1
C(s)+2H2(g)![]() CH4(g) ΔH=-73kJ·mol-1
CH4(g) ΔH=-73kJ·mol-1
2CO(g)![]() C(s)+CO2(g) ΔH=-171kJ·mol-1
C(s)+CO2(g) ΔH=-171kJ·mol-1
(2)天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中
通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 。
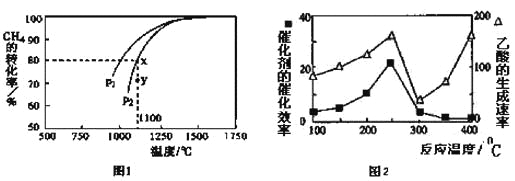
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
2CO(g)+2H2(g)。在密闭容器中通入物质的量浓度均为0.1mol·L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如下图1所示,则压强P1 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正) v(逆)(填“大于”、“小于”或“等于”)。 求Y点对应温度下的该反应的平衡常数K= 。(计算结果保留两位有效数字)
(4) 以二氧化钛表面覆盖CuAl2O4为催化剂,可以将CH4和CO2直接转化成乙酸。
①在不同温度下催化剂的催化效率与乙酸的生成速率如图2所示。250~300℃时,温度升高而乙酸的生成速率降低的原因是 。
②为了提高该反应中CH4的转化率,可以采取的措施是 。
【答案】(1)CO (g)+3H2(g)![]() CH4(g)+ H2O(g) ΔH=-203kJ·mol-1
CH4(g)+ H2O(g) ΔH=-203kJ·mol-1
(2)2NH4HS+O2=2NH3·H2O+2S↓
(3)小于 大于 1.6mol2/L2
(4)①温度超过250oC时,催化剂的催化效率降低
②增大反应压强或增大CO2的浓度
【解析】试题分析:(1)根据盖斯定律,CO与H2反应生成CH4和H2O的热化学方程式为CO (g) + 3H2(g)![]() CH4(g) + H2O(g) ΔH=-203kJ·mol-1。(2)一定条件下向NH4HS溶液中通入空气,NH4HS能够与空气中的氧气反应得到单质硫从而使吸收液再生,其化学方程式为2NH4HS+O2=2NH3·H2O+2S↓。(3)反应CO2(g)+CH4(g)
CH4(g) + H2O(g) ΔH=-203kJ·mol-1。(2)一定条件下向NH4HS溶液中通入空气,NH4HS能够与空气中的氧气反应得到单质硫从而使吸收液再生,其化学方程式为2NH4HS+O2=2NH3·H2O+2S↓。(3)反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)是一个熵增反应,增大压强,化学平衡向气体分子数减小的逆向进行,平衡转化率减小;而同温条件下,压强P1时的转化率大于压强P2时的转化率,因此压强P1小于P2。压强为P2时,在Y点,由于还未达到平衡状态,反应一直向正向进行着,因此v(正)大于v(逆)。由图1可知,在Y点对应温度下,该反应平衡转化率为0.8,则化学平衡常数的计算过程如下:
2CO(g)+2H2(g)是一个熵增反应,增大压强,化学平衡向气体分子数减小的逆向进行,平衡转化率减小;而同温条件下,压强P1时的转化率大于压强P2时的转化率,因此压强P1小于P2。压强为P2时,在Y点,由于还未达到平衡状态,反应一直向正向进行着,因此v(正)大于v(逆)。由图1可知,在Y点对应温度下,该反应平衡转化率为0.8,则化学平衡常数的计算过程如下:
CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始浓度(mol/L) 0.1 0.1 0 0
转化浓度(mol/L) 0.08 0.08 0.16 0.16
平衡浓度(mol/L) 0.02 0.02 0.16 0.16
平衡常数K=![]() mol2/L2
mol2/L2
(4)①250~300℃时,温度升高而乙酸的生成速率降低的原因是温度超过250oC时,催化剂的催化效率降低;②由于催化剂的催化效率在温度超过250时会降低,因此为了提高CH4的转化率,不能一味的升高温度,而是在催化剂催化效率最大时的温度条件下,采用增大反应压强或增大CO2的浓度的方式来提高CH4的转化率。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下列关于实验室制取氨气的说法不正确的是( )
A.可用浓盐酸检验氨气
B.可用浓硫酸干燥氨气
C.可用向下排空气法收集氨气
D.可将浓氨水滴入盛有生石灰的烧瓶制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】300mL Fe2(SO4)3溶液中,含SO42-为11.52g,在该溶液中加入0.1mol/L Ba(OH)2溶液300mL,反应后溶液中Fe3+的物质的量浓度约为
A. 0.1 mol/L B. 0.2 mol/L C. 0.3 mol/L D. 0.4 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器的名称、组装及使用方法是中学化学实验的基础,根据如下图所示实验装置,回答下列问题。

(1)写出下列仪器的名称:
①_____________, ②_____________。
(2)若利用装置Ⅰ分离酒精和水的混合物,还缺少 的仪器是_____________,将仪器补充完整后进行的实验操作的名称为________;②的进水口是______(填“f”或“g”)。实验中,仪器①中需加入沸石,其作用为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示在不同条件下的酶促反应速率变化曲线。据图分析叙述错误的是( )
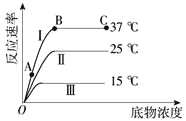
A. 影响AB段反应速率的主要因素是底物浓度
B. 影响BC段反应速率的主要限制因素可能是酶量
C. 温度导致了曲线Ⅰ和Ⅱ的反应速率不同
D. 曲线Ⅰ显示,该酶促反应的最适温度为37 ℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图分别为生物体内分子的部分结构模式图,请据图回答问题:

(1)甲图中的三种物质分别属于动物、植物细胞中的储能物质的是_____,组成这三种物质的单体都是_____。
(2)乙图所示化合物的基本组成单位是___________,即图中字母_______________ 所示的结构表示,各基本单位之间是通过_____________(填“①”“②”或“③”)连接起来 的。
(3)丙图是由________个氨基酸经__________ 过程形成的,氨基酸的结构通式为__________ 。检验丙和戊可以用______________ 试剂。
(4)丁和戊中的 Mg2+、Fe2+体现了无机盐具有什么功能?_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“化学是你,化学是我”.化学与生产、生活密切相关,下列说法错误的是( )
A. 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈
B. 水泥冶金厂常用高压电除去工厂烟尘,利用了胶体的性质
C. 开发利用太阳能、风能、生物能、海洋能等清洁能源,符合“低碳经济”
D. 二氧化硫有漂白性,常用于棉、麻、纸张和食品的漂白
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国的纳米基础研究能力已跻身于世界前列,曾制得一种合成纳米材料,其化学式为RN(N为氮元素,且为-3价)。已知该化合物中的Rn+核外有28个电子,则R元素位于元素周期表的( )
A.第3周期第ⅤA族B.第4周期第ⅢA族
C.第5周期第ⅢA族D.第4周期第ⅤA族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com