
【题目】(1)严重雾霾天气的产生与汽车排放的NO2(N2O4)、CO、NO等气体有关。回答下列问题:用活性炭处理尾气时还可发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
N2(g)+CO2(g) ΔH=-34.0 kJ·mol1,借助传感器在T1℃测得不同时间点上NO和N2的浓度如下:
时间/min 浓度/mol·L1 | 0 | 5 | 10 | 15 | 20 | 25 |
NO | 1.20 | 0.74 | 0.56 | 0.56 | 0.63 | 0.63 |
N2 | 0 | 0.23 | 0.32 | 0.32 | 0.36 | 0.36 |
15 min后,只改变某一条件,反应重新达到平衡;根据上表数据判断改变的条件可能是____(填字母)。
a.适当缩小容器的体积 b.加入适量的活性炭
c.通入适量的NO d.适当升高温度
(2)750K下,在恒容密闭容器中,充入一定量的甲醇,发生反应CH3OH(g)![]() HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
HCHO(g)+H2(g),若起始压强为101kPa,达到平衡转化率为50.0%,则反应的平衡常数Kp=______(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,忽略其它反应)。
(3)某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,在催化剂的作用下发生反应:CO(g)+2H2(g) ![]() CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
CH3OH(g)。经过5 min后,反应达到平衡,此时转移电子6 mol。
①若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时v(正)________v(逆)(填“>”“<”或“=”)。在其他条件不变的情况下,再增加2 mol CO与5 mol H2,达到新平衡时,CO的转化率________(填“增大”“减小”或“不变”)。
②下列不能说明该反应已达到平衡状态的是________。
a.CH3OH的质量不变 b.混合气体的平均相对分子质量不再改变
c.v逆(CO)=2v正(H2) d.混合气体的密度不再发生改变
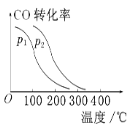
③在一定压强下,容积为V L的容器充入a mol CO与2a mol H2,在催化剂作用下反应生成甲醇,平衡转化率与温度、压强的关系如图所示。则p1________p2(填“大于”“小于”或“等于”,下同),ΔH________0。
【答案】ac 50.5KPa(单位可以不带) > 增大 cd 小于 小于
【解析】
(1)15 min后,只改变某一条件,反应重新达到平衡,由图表数据分析可知一氧化氮,氮气浓度都增大;
a. 该反应前后是气体体积不变的反应,适当缩小容器的体积,平衡不移动,但气体物质的浓度均增大,a项符合;
b. 加入适量的活性炭,对平衡无影响,b项不符合;
c. 通入适量的NO,平衡正向移动,重新达到平衡后,一氧化氮、氮气的浓度均增大,c项符合;
d. 适当升高温度,平衡逆向移动,一氧化氮浓度增大,氮气的浓度减小,d项不符合;
综上所述,改变的条件可能是ac;
(2)若起始压强为101kPa,达到平衡转化率为50.0%,设起始甲醇物质的量为1mol,可列出三段式:
CH3OH (g) ![]() HCHO(g) + H2(g)
HCHO(g) + H2(g)
起始(mol) 1 0 0
变化(mol) 0.5 0.5 0.5
平衡(mol) 0.5 0.5 0.5
根据恒温恒容时,压强比等于物质的量之比,得到![]() ,解得平衡时混合气体的总压强为
,解得平衡时混合气体的总压强为![]() =151.5kPa,则各气体的分压为:P(CH3OH)=P(HCHO)=P(H2)=
=151.5kPa,则各气体的分压为:P(CH3OH)=P(HCHO)=P(H2)=![]() =50.5kPa,则
=50.5kPa,则![]()
(3)①某温度,将2 mol CO与5 mol H2的混合气体充入容积为2 L的密闭容器中,经过5 min后,反应达到平衡,依据化学方程式可知转移电子4mol,消耗CO物质的量为1mol,此时转移电子6mol,则消耗CO物质的量为1.5mol,可列出三段式:
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
起始(mol) 2 5 0
变化(mol) 1.5 3 1.5
平衡(mol) 0.5 2 1.5
平衡浓度(mol/L) 0.25 1 0.75
则平衡常数![]() ,若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时c(CO)=1.25mol/L,c(H2)=1mol/L,c(CH3OH)=1.5mol/L,此时反应的浓度商
,若保持体积不变,再充入2 mol CO和1.5 mol CH3OH,此时c(CO)=1.25mol/L,c(H2)=1mol/L,c(CH3OH)=1.5mol/L,此时反应的浓度商![]() ,则反应正向进行,v(正)>v(逆);在其他条件不变的情况下,再增加2 mol CO与5 mol H2,同等程度改变反应物的用量,新平衡与原平衡相比,相当于增大压强,该反应CO(g)+2H2(g)
,则反应正向进行,v(正)>v(逆);在其他条件不变的情况下,再增加2 mol CO与5 mol H2,同等程度改变反应物的用量,新平衡与原平衡相比,相当于增大压强,该反应CO(g)+2H2(g) ![]() CH3OH(g)的正反应方向是气体体积减小的反应,因此加压平衡正向移动,一氧化碳的转化率增大;
CH3OH(g)的正反应方向是气体体积减小的反应,因此加压平衡正向移动,一氧化碳的转化率增大;
②该反应CO(g)+2H2(g) ![]() CH3OH(g)是正反应气体体积减小的反应,反应达到平衡的标志是正逆反应速率相等,各组分含量保持不变,分析选项中变量不变说明反应达到平衡状态。
CH3OH(g)是正反应气体体积减小的反应,反应达到平衡的标志是正逆反应速率相等,各组分含量保持不变,分析选项中变量不变说明反应达到平衡状态。
a. CH3OH的质量不变,说明反应达到平衡状态,a项不符合;
b. 反应前后气体质量不变,反应前后气体物质的量变化,则平均相对分子质量会随着反应的进行变化,当混合气体的平均相对分子质量不再改变,说明反应达到平衡状态,b项不符合;
c. 达到化学平衡时,正逆反应速率相等,指的是用同种物质表示的正逆反应速率相等,根据反应速率之比等于化学方程式计量数之比可知,任意时刻均有2v正(CO)=v正(H2),当v正(CO)=v逆(CO)时,达到平衡状态,则应用2v逆(CO)=v正(H2)表示反应达到平衡状态,v逆(CO)=2v正(H2)不能说明反应达到平衡状态,c项符合;
d. 反应前后气体质量不变,容器体积不变,混合气体的密度始终不发生改变,不能说明反应达到平衡状态,d项符合;
故答案为:cd;
③相同温度下,同一容器中,增大压强,平衡向正反应方向移动,则CO的转化率增大,根据图象知,p1小于p2,温度升高一氧化碳转化率减小,说明升温平衡逆向进行,则逆反应为吸热反应,正反应为放热反应,△H<0。


科目:高中化学 来源: 题型:
【题目】关于常温下pH=2的H3PO4溶液,下列说法正确的是( )
A.c(H3PO4)=![]() mol/L
mol/L
B.c(H+)=c(H2PO![]() )+2c(HPO
)+2c(HPO![]() )+3c(PO
)+3c(PO![]() )+c(OH-)
)+c(OH-)
C.加水稀释使电离度增大,溶液pH减小
D.加入NaH2PO4固体,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列几个离子反应:
① Cr2O![]() +14H++6Cl-===2Cr3++3Cl2↑+7H2O
+14H++6Cl-===2Cr3++3Cl2↑+7H2O
② 2Fe2++Br2===2Fe3++2Br- ③ 2Br-+Cl2=== Br2+2Cl-
④ 2Fe3++SO2+2H2O===2Fe2++SO![]() +4H+
+4H+
下列有关性质的比较中正确的是( )。
A. 氧化性:Cr2O![]() >Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O
>Cl2>Fe3+ B. 氧化性:Cl2>Br2>Cr2O![]()
C. 还原性:SO2<Fe2+<Br- D. 还原性:Cl->Cr3+>Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.用Cu片作阳极电解饱和食盐水:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
B.用两个铜片作电极电解AgNO3溶液:Cu+2Ag+![]() 2Ag+Cu2+
2Ag+Cu2+
C.用石墨作电极电解FeCl3溶液:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用石墨作电极电解CuBr2溶液:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯二氧化硅可用下列流程制得。下列说法不正确的是( )
![]()
A.X可用作木材防火剂
B.步骤Ⅱ的反应是Na2SiO3+H2SO4═H2SiO3↓+Na2SO4
C.步骤Ⅱ中的稀硫酸可用CO2来代替
D.步骤Ⅲ若在实验室完成,一般在蒸发皿中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积不变的密闭容器中,可逆反应2SO2(g)+O2(g)![]() 2SO3(g)达到平衡的标志是
2SO3(g)达到平衡的标志是
A.单位时间内生成1molO2的同时,有2molSO3分解
B.混合气体的密度保持不变
C.混合气体的质量不再改变
D.SO2与SO3的体积比不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计了如图装置,该装置能制取Cl2,并进行相关性质实验,且可利用装置G储存多余的氯气。
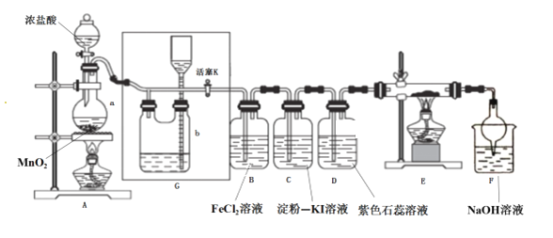
(1)A中发生反应的化学反应方程式为________________________________
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯,回答下列问题:
①在装置D中能看到的实验现象分别是 ___________________ ;
②在装置E的硬质玻璃管内盛有碳粉,发生氧化还原反应,产物为CO2和HCl,则E中发生反应的化学方程式为______________________________;
③装置F中球形干燥管的作用是____________________________;
(3)储气瓶b内盛放的试剂是______________________________;
(4)B处发生反应的离子方程式为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是( )
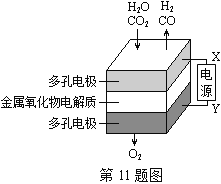
A. X是电源的负极
B. 阴极的反应式是:H2O+2eˉ=H2+O2ˉCO2+2eˉ=CO+O2ˉ
C. 总反应可表示为:H2O+CO2H2+CO+O2
D. 阴、阳两极生成的气体的物质的量之比是1︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙实验小组设计如下实验装置分别制备SnCl4和漂白粉。
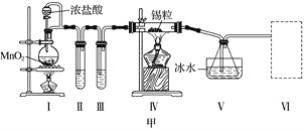
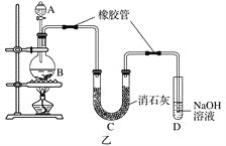
(1)已知:a.金属锡熔点231 ℃,化学活泼性与铁相似;
b.干燥的氯气与熔融金属锡反应生成SnCl4,SnCl4的沸点114 ℃;
c.SnCl2、SnCl4均易水解,易溶于有机溶剂,且Sn2+易被氧化。根据图甲装置回答:
①试管Ⅱ中的试剂是____________________,Ⅲ中的试剂是________________________。
②Ⅵ处装置最好选用________(填字母)。
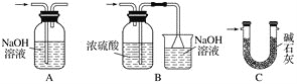
③Ⅰ处装置中反应的离子方程式是____________________________________________。
④实验结束后,欲回收利用装置Ⅰ中未反应完的MnO2,需要的玻璃仪器有______________。
(2)已知:①Cl2与潮湿的消石灰反应是放热反应;②温度较高时Cl2与潮湿Ca(OH)2的反应为6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。
根据图乙装置回答:此实验所得Ca(ClO)2产率较低的理由是
①________________________________________________________________________;
②________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com