
【题目】制备氰氨基化钙的化学方程式为CaCO3+2HCN===CaCN2+CO↑+H2↑+CO2↑,在反应中( )
A. 氢元素被氧化,碳元素被还原 B. HCN是氧化剂,CaCO3是还原剂
C. CaCN2是氧化产物,H2是还原产物 D. CO为氧化产物,H2为还原产物
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.葡萄糖与果糖、淀粉与纤维素均互为同分异构体
B.纤维素、蔗糖、葡萄糖和脂肪在一定条件下都可发生水解反应可室
C.汽油、柴油的主要成分为烃类,而花生油、甘油的主要成分为酯类
D.淀粉、纤维素、蛋白质都是天然高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
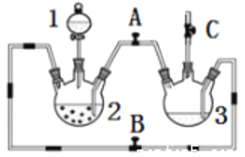
(1)稀硫酸应放在___________中(填写仪器名称).
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关_________、打开开关______就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由____________________________.
(3)该实验使用铁粉,除反应速率可能太快外,还可能会造成的不良后果是____________.
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4· FeSO46H2O] (式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是________________ 。
A.用冷水洗 B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗高锰酸钾溶液体积/mL | 25.52 | 25.02 | 24.98 |
滴定过程中发生反应的离子方程式为_______________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
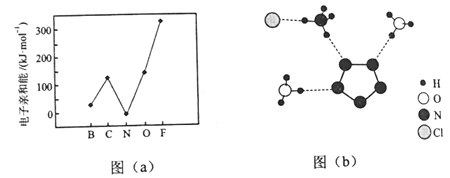
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关硫及其化合物的说法正确的是( )
A.浓硫酸具有吸水性,因而能使蔗糖碳化
B.将SO2通入品红溶液,溶液褪色后加热恢复原色;将SO2通入溴水,溴水褪色后加热也能恢复原色
C.在反应SO2+2H2S=3S+2H2O中SO2作氧化剂
D. 硫粉在过量的纯氧中燃烧可以生成SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 0.1 molL-1的NaCl溶液是指此溶液中含有0.1 mol NaCl
B. 1 molL-1的BaCl2溶液中,Cl-的物质的量浓度为2 molL-1
C. 从1 L 0.5 molL-1的NaCl溶液中取出100 mL溶液,其物质的量浓度变为0.05 molL-1
D. 在![]() 和
和![]() 的混合水溶液中,如果
的混合水溶液中,如果![]() 和
和![]() 的物质的量浓度相等,则
的物质的量浓度相等,则![]() 和
和![]() 的物质的量浓度相同
的物质的量浓度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在湿法炼锌的电解循环溶液中,较高浓度的![]() 会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去
会腐蚀阳极板而增大电解能耗。可向溶液中同时加入Cu和CuSO4,生成CuCl沉淀从而除去![]() 。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是
。根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是

A. ![]() 的数量级为
的数量级为![]()
B. 除![]() 反应为Cu+Cu2++2
反应为Cu+Cu2++2![]() =2CuCl
=2CuCl
C. 加入Cu越多,Cu+浓度越高,除![]() 效果越好
效果越好
D. 2Cu+=Cu2++Cu平衡常数很大,反应趋于完全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中充有氢气、氧气和氯气,点燃后刚好全部完全反应,再冷却得到质量分数为33.6%的盐酸,则原容器中三种气体的体积比为( )
A. 3:1:1 B. 4:1:2 C. 8:4:1 D. 9:4:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com