
【题目】![]() 可用作食品添加剂。
可用作食品添加剂。![]() 能发生以下反应:
能发生以下反应:
![]()
![]() 淡黄色
淡黄色![]()
某化学兴趣小组进行以下探究。回答有关问题:
![]() 制取
制取![]()
反应原理:![]()
![]()
用如图所示装置进行实验。
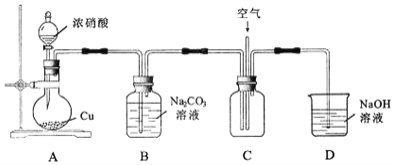
![]() 铜与浓硝酸反应的离子方程式为______。
铜与浓硝酸反应的离子方程式为______。
![]() 实验过程中,需控制B中溶液的
实验过程中,需控制B中溶液的![]() ,否则产率会下降,理由是______。
,否则产率会下降,理由是______。
![]() 往C中通入空气的目的是______
往C中通入空气的目的是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
![]() 反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。
反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。
![]() 测定粗产品中
测定粗产品中![]() 的含量
的含量
称取mg粗产品,溶解后稀释至![]() 取出
取出![]() 溶液,用
溶液,用![]() 酸性溶液平行滴定三次,平均消耗的体积为VmL。
酸性溶液平行滴定三次,平均消耗的体积为VmL。
已知:![]()
![]() 稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______
稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______![]() 填标号
填标号![]() 。
。
A.容量瓶![]() 量筒
量筒![]() 胶头滴管
胶头滴管![]() 锥形瓶
锥形瓶
![]() 当观察到______时,滴定达到终点。
当观察到______时,滴定达到终点。
![]() 粗产品中
粗产品中![]() 的质量分数为______
的质量分数为______![]() 用代数式表示
用代数式表示![]() 。
。
![]() 设计实验方案证明母液中含有
设计实验方案证明母液中含有![]() ______
______![]() 限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液
限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液![]() 。
。
【答案】![]() 如果
如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体
,亚硝酸盐会转化为硝酸盐和NO气体 ![]() 过滤 A、C 溶液出现粉红色,且半分钟内不褪色
过滤 A、C 溶液出现粉红色,且半分钟内不褪色 ![]() 取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有
取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有![]()
【解析】
(1)①铜与浓硝酸反应生成硝酸铜、二氧化氮和水;
②3NO2-+2H+=NO3-+2NO↑+H2O 分析判断;
③空气中氧气和一氧化氮反应生成二氧化氮;
④溶液中得到溶质晶体的方法是浓缩蒸发、冷却结晶、过滤洗涤、干燥等操作得到;
(2)①称取mg粗产品,溶解后稀释至250mL是配制溶液,结合配制溶液的步骤选择仪器;
②高锰酸钾溶液为紫红色,利用溶液颜色判断反应终点;
③2MnO4-+6H++5NO2-=5NO3-+2Mn2++3H2O,结合反应定量关系计算;
(3)3NO2-+2H+=NO3-+2NO↑+H2O,2NO+O2=2NO2,结合反应最后生成红棕色气体二氧化氮检验。
![]() 铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为:
铜与浓硝酸反应生成硝酸铜、二氧化氮和水,反应的离子方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 实验过程中,需控制B中溶液的
实验过程中,需控制B中溶液的![]() ,否则产率会下降,理由是如果
,否则产率会下降,理由是如果![]() ,
,![]() ,亚硝酸盐会转化为硝酸盐和NO气体,故答案为:如果
,亚硝酸盐会转化为硝酸盐和NO气体,故答案为:如果![]() ,亚硝酸盐会转化为硝酸盐和NO气体;
,亚硝酸盐会转化为硝酸盐和NO气体;
![]() 往C中通入空气的目的是一氧化氮和氧气反应生成二氧化氮,反应的化学方程式为:
往C中通入空气的目的是一氧化氮和氧气反应生成二氧化氮,反应的化学方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
![]() 反应结束后,B中溶液经蒸发浓缩、冷却结晶、过滤等操作,可得到粗产品晶体和母液,故答案为:过滤;
反应结束后,B中溶液经蒸发浓缩、冷却结晶、过滤等操作,可得到粗产品晶体和母液,故答案为:过滤;
![]() 稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有容量瓶、胶头滴管等,故选AC,故答案为:A、C;
稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有容量瓶、胶头滴管等,故选AC,故答案为:A、C;
![]() ,高锰酸钾溶液为紫红色,利用溶液颜色判断反应终点,滴入最后一滴,溶液出现粉红色,且半分钟内不褪色,故答案为:溶液出现粉红色,且半分钟内不褪色;
,高锰酸钾溶液为紫红色,利用溶液颜色判断反应终点,滴入最后一滴,溶液出现粉红色,且半分钟内不褪色,故答案为:溶液出现粉红色,且半分钟内不褪色;
![]() 称取mg粗产品,溶解后稀释至
称取mg粗产品,溶解后稀释至![]() 取出
取出![]() 溶液,用
溶液,用![]() 酸性溶液平行滴定三次,平均消耗的体积为VmL。
酸性溶液平行滴定三次,平均消耗的体积为VmL。
![]()
2 5
![]() n
n
![]() ,
,
250ml溶液中所含物质的量![]() ,粗产品中
,粗产品中![]() 的质量分数
的质量分数![]() ,故答案为:
,故答案为:![]() ;
;
![]() ,
,![]() ,结合反应最后生成红棕色气体二氧化氮检验,设计实验方案:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有
,结合反应最后生成红棕色气体二氧化氮检验,设计实验方案:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有![]() ,故答案为:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有
,故答案为:取样,加硝酸,若有气泡产生,且生成的气体遇空气变红棕色,证明含有![]()


 智能训练练测考系列答案
智能训练练测考系列答案科目:高中化学 来源: 题型:
【题目】将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔性碳棒)持续通入甲烷,在标准状况下,消耗甲烷体积VL。则下列说法正确的是( )

A.OH-由A端移向B端
B.0<V≤22.4L时,电池总反应的化学方程式为:CH4 + 2O2 + KOH = KHCO3 + 2H2O
C.22.4L<V≤44.8L时,负极电极反应为:CH4 - 8e- + 9CO32- + 3H2O = 10HCO3-
D.V=33.6L时,溶液中阴离子浓度大小关系为:c(CO32- )>c(HCO3- )>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①298K时K(HF)=3.5×10-4,Ksp(CaF2)=1.8×10-7
②HF(aq)![]() H+(aq)+F-(aq)△H<0
H+(aq)+F-(aq)△H<0
根据以上已知信息判断下列说法正确的是( )
A. 298K时,加蒸馏水稀释HF溶液, ![]() 保持不变
保持不变
B. 308K时,HF的电离常数Ka>3.5×10-4
C. 298K时,向饱和CaF2溶液中加入少量CaCl2,Ksp(CaF2)会减小
D. 2HF(aq)+Ca2+(aq)![]() CaF2(s)+2H+(aq)K≈0.68
CaF2(s)+2H+(aq)K≈0.68
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O![]() MgCl2+6H2O
MgCl2+6H2O
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
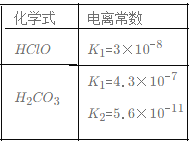
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
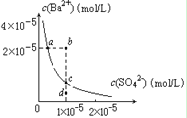
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 的两种一元碱溶液X、Y各
的两种一元碱溶液X、Y各![]() ,分别稀释至
,分别稀释至![]() ,其pH与溶液体积
,其pH与溶液体积![]() 的关系图所示,下列说法不正确的是( )
的关系图所示,下列说法不正确的是( )
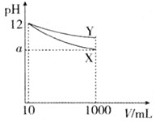
A.若X、Y都是弱碱,则![]()
B.等浓度的X、Y溶液的碱性:![]()
C.稀释至![]() 时两种碱的物质的量浓度:
时两种碱的物质的量浓度:![]()
D.完全中和等体积相同pH的X、Y两溶液时,消耗同浓度盐酸的体积![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积可变的密闭容器中充入2 mol A和1 mol B发生反应:mA(g) + nB(g) ![]() pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
pC(g)。在一定温度下达到平衡时,分别得到A的物质的量浓度如下表,以下说法正确的是
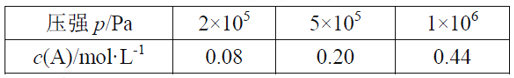
A. 维持压强2×105Pa,若反应开始后5min时达到平衡,则v(A)=0.016mol/(L·min)
B. P从2×105Pa增加到5×105Pa时,平衡逆向移动
C. P为1×106Pa时,平衡常数表达式K=![]()
D. 其它条件相同时,在上述三个压强下分别发生该反应。A的转化率随时间变化曲线如图所示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学课外研究小组为验证浓硫酸与金属Zn反应产生的气体中含SO2和H2,进行了下列实验活动:
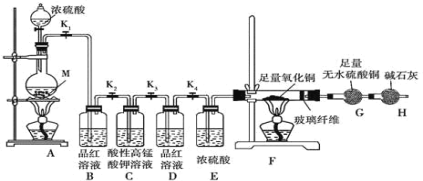
(1)在装入药品前,甲同学需检查装置_____。
(2)填写下表中的实验现象:_____。
装置 | B | F | G |
实验现象 |
(3)装置C的作用是_____,写出装置C中发生反应的离子方程式_____。
(4)装置D的作用是_____。
(5)SO2是大气污染物之一,也是某工业生产中的主要尾气之一。某校兴趣小组欲采用下列方案测定此工业尾气中的SO2的含量。
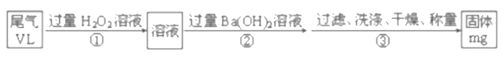
通过的尾气体积为VL(已换算成标准状况)时,该尾气中SO2含量(体积分数)为_____(用含有V、m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定NaClO与NaClO3的物质的量之比为1:3,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为![]()
![]()
A.3:11B.11:3C.1:4D.4:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
(1)如图为某实验小组依据氧化还原反应_______________(用离子方程式表示)设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差 12 g,导线中通过__________mol 电子。
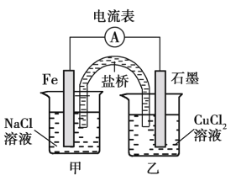
(2)其他条件不变,若将 CuCl2溶液换为 NH4Cl 溶液,石墨电极发生的电极反应为___________,这是由于 NH4Cl 溶液显_______________(填“酸性”、“碱性” 或“中性”)。用吸管吸出铁片附近的溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴 KSCN 溶液,溶液变红,继续滴加过量新制饱和氯水,溶液颜色褪去,同学们对此做了多种假设,某同学的假设:“溶液中的+3 价铁被氧化为更高价态。” 如果+3 价铁被氧化为 FeO42-,写出发生反应的离子方程式___________________。
(3)其他条件不变,若将盐桥换成弯铜导线与石墨连成的形装置如图所示,一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是____________,电极反应为__________;乙装置中石墨(Ⅰ)为__________(填“正”、 “ 负” 、 “ 阴”或“阳”)极。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com