
【题目】下列说法正确的是( )
A.用坩埚灼烧MgCl2·6H2O的反应式 MgCl2·6H2O![]() MgCl2+6H2O
MgCl2+6H2O
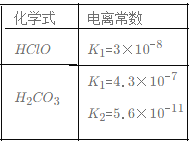
B.根据下表提供的数据,等物质的量浓度的NaClO、NaHCO3混合溶液中,有c(HCO3-)>c(ClO-)>c(OH-) 。
C.常温下,将pH=2的稀硫酸稀释10倍,其中各离子的物质的量浓度都变为原来的十分之一。
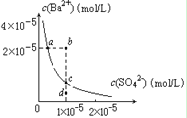
D.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示,溶度积常数Ksp=c(Ba2+)·c(SO42-)。则加入 Na2SO4可使溶液由a点变到b点;通过蒸发可以使溶液由d 点变到c 点。
【答案】B
【解析】
A. MgCl2在加热过程中会发生水解得不到MgCl2,故A错误;
B. 电离常数表示其电离程度得相对大小。根据表中数据可知酸性强弱大小顺序为H2CO3[>HclO>HCO3-,因为酸越强,相应得盐越容易水解,即等物质的量浓度的NaClO、NaHCO3混合溶液中,前者的水解程度大于后者,且水解都显碱性,故B正确;
C. pH=2的稀硫酸,则稀硫酸的浓度为0.005mol/L,但在稀释过程中氢离子的物质的量是增加的,即氢离子的物质的量浓度略大于原来的十分之一,故C错误;
D. a点是饱和溶液,当加入Na2SO4时增大c(SO42-),有晶体析出,所以c(Ba2+)减小。D点是不饱和溶液,若通过蒸发溶剂,变成饱和溶液,则c(SO42-)和c(Ba2+)均应该增大,故D错误;
答案选B。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
【题目】某芳香族酯类化合物甲的分子式为C14H10O5,1 mol甲水解后只生成一种产物乙,其物质的量为2 mol,下列说法正确的是( )
A. 符合上述条件的甲共有3种B. 1 mol甲最多可以和3 mol NaOH反应
C. 乙不能和溴水发生反应D. 2 mol乙最多可以和1 mol Na2CO3反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烷、乙烯等有机物在工业上有广泛的应用,回答下列问题:
(1)已知:①C3H8(g)+5O2(g)= 3CO2(g)+4H2O(l) △H1
②C(石墨,s)+O2(g)= CO2(g) △H2
③2H2(g)+O2(g)= 2H2O(l) △H3
写出丙烷气体(C3H8)分解得到石墨(C)和氢气的热化学方程式:___。
(2)煤制乙烯包括合成气制备、合成气制甲醇、甲醇分解三步,则:
①生产合成气的反应:C(s)+H2O(g)=CO(g)+H2(g)在高温下能自发进行,则该反应的___(填选项)。
a.△H>0 △S>0 b.△H>0 △S<0
c.△H<0 △S>0 d.△H>0 △S<0
②用合成气制备甲醇的反应为:CO(g)+ 2H2(g)![]() CH3OH(g)(不发生其他反应)。四个容器中起始时压强、容积均相同,维持恒温,控制条件如下表;
CH3OH(g)(不发生其他反应)。四个容器中起始时压强、容积均相同,维持恒温,控制条件如下表;
编号 | 条件控制 | CO(g)/moL | H2(g)/moL | CH3OH(g)/moL |
A | 维持恒容 | 0.2 | 0.4 | 0 |
B | 维持恒容 | 0.1 | 0.2 | 0.1 |
C | 维持恒容 | 0.4 | 0.8 | 0 |
D | 维持恒压 | 0.4 | 0.8 | 0 |
达到平衡时,四个容器中甲醇的体积分数由大到小的关系是___(用字母表示)。
(3)在两个容积均为1L的密闭容器中以不同的氢碳比[n(H2)/n(CO2)]充入H/span>2和CO2,在一定条件下发生反应:2CO2(g)+ 6H2(g)![]() C2H4(g)+ 4H2O(g)△H。CO2的平衡转化率α(CO2)与温度的关系如图所示。
C2H4(g)+ 4H2O(g)△H。CO2的平衡转化率α(CO2)与温度的关系如图所示。
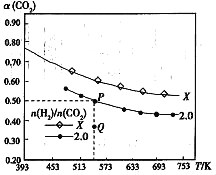
①此反应的平衡常数表达式K=___,P点对应温度下,K的值为___。
②该反应的△H___0(填“>”“<”或“=”),判断的理由是___。
③氢碳比:X___2.0(填“>”“<”或“=”)。
④在氢碳比为2.0时,Q点v(逆)___P点的v(逆)(填“>”“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示,其中甲池的总反应式为2CH3OH + 3O2 + 4KOH===2K2CO3 + 6H2O,下列说法正确的是( )
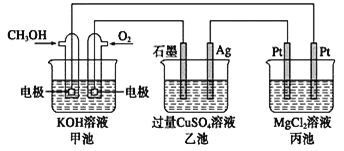
A. 甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B. 甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O===CO32-+ 8H+
C. 甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
D. 反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将![]()
![]() 固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
固体溶于水配成100mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入的物质 | 结论 | |
A |
| 反应结束后, |
B |
| 溶液中 |
C |
| 由水电离出的 |
D |
| 反应完全后,溶液pH减小, |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在周期表中位置如图,其中W原子的次外层电子数是最内层电子数与最外层电子数的电子数之和。下列说法不正确的是
![]()
A. 最简单的氢化物的沸点:X>W
B. 元素的非金属性:Z>W>Y
C. 简单离子的半径大小:Y>W>Z
D. 氧化物对应水化物的酸性:Y<W<Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 可用作食品添加剂。
可用作食品添加剂。![]() 能发生以下反应:
能发生以下反应:
![]()
![]() 淡黄色
淡黄色![]()
某化学兴趣小组进行以下探究。回答有关问题:
![]() 制取
制取![]()
反应原理:![]()
![]()
用如图所示装置进行实验。
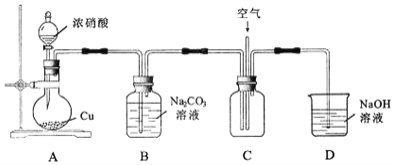
![]() 铜与浓硝酸反应的离子方程式为______。
铜与浓硝酸反应的离子方程式为______。
![]() 实验过程中,需控制B中溶液的
实验过程中,需控制B中溶液的![]() ,否则产率会下降,理由是______。
,否则产率会下降,理由是______。
![]() 往C中通入空气的目的是______
往C中通入空气的目的是______![]() 用化学方程式表示
用化学方程式表示![]() 。
。
![]() 反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。
反应结束后,B中溶液经蒸发浓缩、冷却结品、______等操作,可得到粗产品晶体和母液。
![]() 测定粗产品中
测定粗产品中![]() 的含量
的含量
称取mg粗产品,溶解后稀释至![]() 取出
取出![]() 溶液,用
溶液,用![]() 酸性溶液平行滴定三次,平均消耗的体积为VmL。
酸性溶液平行滴定三次,平均消耗的体积为VmL。
已知:![]()
![]() 稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______
稀释溶液时,需使用的玻璃仪器除烧杯、玻璃棒外,还有______![]() 填标号
填标号![]() 。
。
A.容量瓶![]() 量筒
量筒![]() 胶头滴管
胶头滴管![]() 锥形瓶
锥形瓶
![]() 当观察到______时,滴定达到终点。
当观察到______时,滴定达到终点。
![]() 粗产品中
粗产品中![]() 的质量分数为______
的质量分数为______![]() 用代数式表示
用代数式表示![]() 。
。
![]() 设计实验方案证明母液中含有
设计实验方案证明母液中含有![]() ______
______![]() 限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液
限选用的试剂:硝酸、硝酸银溶液、硝酸钡溶液、氯化钡溶液![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c、d、e是含有一种相同元素的五种物质,可发生如下转化:
![]()
其中: a是单质;b是气体;c、d是氧化物;e是最高价氧化物对应的水化物。
(1)如果a是一种淡黄色粉末固体,试推断这五种物质(用化学式表示):
a______;b______;c______;d______;e______。
(2)如果a是一种常见气体,试推断这五种物质(用化学式表示):
a______;b______;c______;d______;e______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国是最早记载丹砂的药用价值和炼制方法的,为了使人民重视丹砂,我国曾发行面值为10分的丹砂邮票。汞单质及其化合物在工业生产和科学研究上有着广泛用途。丹砂炼汞的反应原理包括以下两个反应:
反应I:HgS+O2![]() Hg+SO2
Hg+SO2
反应II:4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
(1)反应I中,还原产物是______,每生成1个SO2分子,转移电子数为______。
(2)反应II中,HgS是________(填“氧化剂”、“还原剂”或“氧化剂和还原剂”),用双线桥法标出反应II中电子转移的方向和数目。________
4HgS+4CaO![]() 4Hg+3CaS+CaSO4
4Hg+3CaS+CaSO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com