
【题目】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
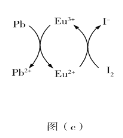
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子![]() ,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱![]() 中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
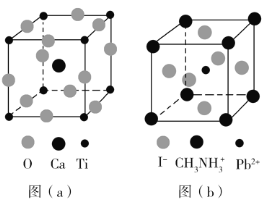
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理_______、_______。
【答案】1s22s22p63s23p63d24s2 TiF4为离子化合物,熔点高,其他三种均为共价化合物,随相对分子质量的增大分子间作用力增大,熔点逐渐升高 O>Ti>Ca 离子键 12 Ti4+ sp3 ![]() 2Eu3++Pb=2Eu2++Pb2+ 2Eu2++I2=2Eu3++2I
2Eu3++Pb=2Eu2++Pb2+ 2Eu2++I2=2Eu3++2I
【解析】
(1)考查了对基态原子电子排布规律的认识;(2)考查了不同类型的晶体的熔沸点比较,相同类型的晶体的熔沸点比较;(3)考查了电负性的周期性变化规律,微粒间的相互作用以及晶胞中离子的配位数;(4)考查了晶胞中微粒的位置和杂化理论,晶体密度的计算问题;(5)重点考查通过反应历程图,来书写离子方程式等。
(1)钛元素是22号元素,故其基态原子的核外电子排布式为1s22s22p63s23p63d24s2或[Ar]3d24s2;故答案为:1s22s22p63s23p63d24s2或[Ar]3d24s2;
(2) 一般不同的晶体类型的熔沸点是原子晶体>离子晶体>分子晶体,TiF4是离子晶体,其余三种则为分子晶体,故TiF4的熔点高于其余三种物质;TiCl4、TiBr4、TiI4均为分子晶体,对于结构相似的分子晶体,则其相对分子质量越大,分子间作用力依次越大,熔点越高;故答案为:TiF4是离子晶体,其余三种则为分子晶体,故TiF4的熔点高于其余三种物质;TiCl4、TiBr4、TiI4均为分子晶体,相对分子质量依次增大,分子间作用力依次增强,故熔点依次升高;
(3)CaTiO3晶体中含有Ca、Ti、O三种元素,Ca、Ti是同为第四周期的金属元素,Ca在Ti的左边,根据同一周期元素的电负性从左往右依次增大,故Ti>Ca,O为非金属,故其电负性最强,故三者电负性由大到小的顺序是:O>Ti>Ca,金属阳离子和氧负离子之间以离子键结合,离子晶体晶胞中某微粒的配位数是指与之距离最近且相等的带相反电性的离子,故Ca2+的配位数必须是与之距离最近且相等的氧离子的数目,从图(a)可知,该数目为三个相互垂直的三个面上,每一个面上有4个,故Ca2+的配位数是12;故答案为:O>Ti>Ca;离子键;12;
(4)比较晶胞(a)(b)可知,将图(b)中周围紧邻的八个晶胞中体心上的离子连接起来,就能变为图(a)所示晶胞结构,图(b)中体心上的Pb2+就变为了八个顶点,即相当于图(a)中的Ti4+;图(b)中顶点上的I-就变成了体心,即相当于图(a)中的Ca2+;图(b)面心上中的![]() 就变成了棱心,即相当于图(a)中的O2-;故图(b)中的Pb2+与图(a)中的Ti4+的空间位置相同;有机碱
就变成了棱心,即相当于图(a)中的O2-;故图(b)中的Pb2+与图(a)中的Ti4+的空间位置相同;有机碱![]() 中N原子上无孤对电子,周围形成了4个
中N原子上无孤对电子,周围形成了4个![]() 键,故N原子采用sp3杂化;从图(b)可知,一个晶胞中含有Pb2+的数目为
键,故N原子采用sp3杂化;从图(b)可知,一个晶胞中含有Pb2+的数目为![]() 个,
个,![]() 的数目为
的数目为![]() 个,I-的数目为
个,I-的数目为![]() 个,故晶胞的密度为
个,故晶胞的密度为![]() ,故答案为:Ti4+;sp3;
,故答案为:Ti4+;sp3;![]() ;
;
(5)从作用原理图(c)可以推出,这里发生两个离子反应方程式,左边发生Pb + 2Eu3+= Pb2++ 2Eu2+,右边发生I2+ 2Eu2+= 2Eu3++ 2I-,故答案为:Pb + 2Eu3+= Pb2++ 2Eu2+;I2+ 2Eu2+= 2Eu3++ 2I-


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】将ag某物质在足量氧气中充分燃烧再将气体生成物通入足量的Na2O2充分反应,固体增重为bg,若a<b,则该物质可能是( )
A. H2B. COC. 乙酸(CH3COOH)D. 甲烷(CH4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+I2(g)![]() 2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
2HI(g)ΔH<0。有相同容积的定容密闭容器甲和乙,甲中加入H2和I2各0.1mol,乙中加入HI0.2mol,在相同温度下分别达到平衡。现欲使甲中HI平衡时的百分含量大于乙中HI平衡时的百分含量,则应采取的措施是
A. 甲、乙提高相同温度 B. 甲中加入0.1molHe,乙中不变
C. 甲降低温度,乙增大压强 D. 甲增加0.1molH2,乙增加0.1molI2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是
A.新制饱和氯水使红玫瑰变力白玫瑰,说明含有Cl2
B.加入石蕊溶液,溶液变红,说明该溶液不含HC1O
C.光照新制氯水有气泡逸出,该气体是氧气
D.向氯水中KHCO3粉末有气泡产生,说明绿水中含有HC1O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如右图所示。下列结论不正确的是( )

A. 反应开始4 min内温度对反应速率的影响比浓度大
B. 一段时间后,反应速率减小的原因是c(H+)减小
C. 反应在2~4 min内平均反应速率最大
D. 反应在2~4 min内生成CO2的平均反应速率为v(CO2)=0.06 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知如图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体。
(1)C的化学式是___。
(2)D和E都是大气污染物,D转化成E的化学方程式是___。
(3)E和H的反应中,氧化剂和还原剂的质量比是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等的方面有广泛应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合如图图像回答问题。
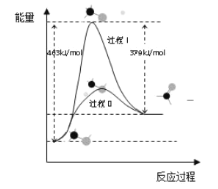
①此反应的热化学方程式是______。
②反应活化能:过程I______过程II (填“>”“=”或“<”)
③过程II温度—转化率图如图,下列说法合理的是_____。
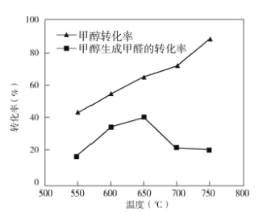
A.甲醇脱氢法制备甲醛过程无副反应发生
B.温度高于650°C催化剂烧结,活性减弱
C.及时分离产品有利于提高甲醇生成甲醛的转化率
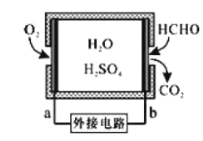
(2)甲醛超标会危害人体健康,需对甲醛往行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为_________
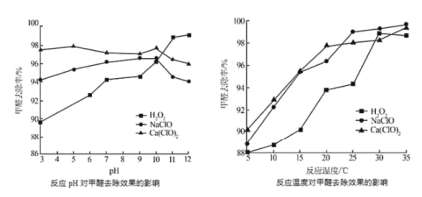
②氧化剂可处理甲醛污染,结合以如图图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为________。
(3)750K下,在恒容密闭容器中,充入的甲醇,发生反应:CH3OH(g)HCHO(g) + H2(g),若起始压强为101kPa, 达到平衡转化率为50.0%, 则反应平衡的常数Kp= ______。(用平衡分压代替平衡农度计算,分压=总压×物质的量分数,忽略其它反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
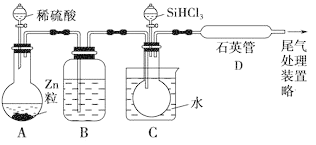
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com