
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
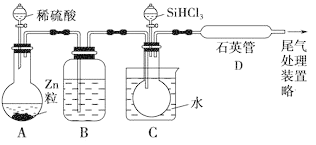
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
【答案】SiO2+2C![]() Si+2CO↑ 分馏(或蒸馏) 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体生成 在该反应温度下,普通玻璃会软化 SiHCl3+H2
Si+2CO↑ 分馏(或蒸馏) 浓硫酸 使滴入烧瓶中的SiHCl3汽化 有固体生成 在该反应温度下,普通玻璃会软化 SiHCl3+H2![]() Si+3HCl 排尽装置内的空气
Si+3HCl 排尽装置内的空气
【解析】
(1)第①步制备粗硅是碳和二氧化硅发生置换反应,生成硅和一氧化碳。
(2)根据沸点SiHCl3(沸点33.0 ℃)、 SiCl4(沸点57.6 ℃)、HCl(沸点-84.7 ℃),提纯SiHCl3。
(3)用锌和稀硫酸制取氢气,用浓硫酸干燥后通入C中,C中烧瓶中的SiHCl3用热水加热后蒸发,和氢气一起进入D中发生反应Si+3HCl![]() SiHCl3+H2,多余的氢气需要尾气处理。
SiHCl3+H2,多余的氢气需要尾气处理。
分离沸点不同的液体的方法是分馏,根据题干“SiHCl3能与H2O强烈反应,在空气中易自燃”可知道H2的作用之一就是排尽装置内空气,防止SiHCl3自燃,而此处的H2必须是干燥的,可知B的作用就是干燥H2,所以选用浓硫酸。由于通入D中应是稳定的SiHCl3与过量H2的气流,所以C装置需要加热,并且是水浴加热,由D装置应加热到1 000~1 100 ℃,所以必须用石英管。


科目:高中化学 来源: 题型:
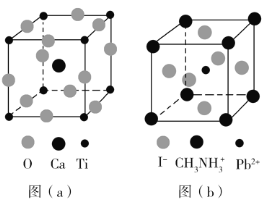
【题目】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子![]() ,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱![]() 中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
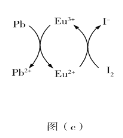
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
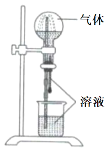
气体 | 溶液 | |
A. | H2S | 稀盐酸 |
B. | HCl | 稀氨水 |
C. | NO | 稀H2SO4 |
D. | CO2 | 饱和NaHCO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明SiO2为酸性氧化物的事实为( )
A.SiO2与H2SO4、HNO3不反应B.SiO2+4HF=SiF4↑+2H2O
C.SiO2+2KOH=K2SiO3+H2OD.SiO2+2C![]() Si+2CO↑
Si+2CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足下图物质一步转化关系的选项是
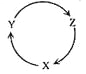
选项 | X | Y | Z |
A | Na | NaOH | NaHCO3 |
B | Cu | CuSO4 | Cu(OH)2 |
C | C | CO | CO2 |
D | Si | SiO2 | H2SiO3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是制取SO2并验证SO2某些性质的装置图。
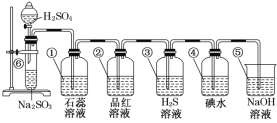
试回答:
(1)⑥中发生反应的化学方程式为___。
(2)①中的实验现象为___,此实验证明SO2是___氧化物。
(3)②中的品红溶液___,证明SO2有___。
(4)③中的H2S溶液____,证明SO2有___。
(5)④中的碘水___,证明SO2有____。
(6)⑤中NaOH溶液的作用是___,有关反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
A.原子序数:![]() B.离子半径:Am+>Bn-
B.离子半径:Am+>Bn-
C.原子半径:![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%(密度为1.84g/cm3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
(1)需要取浓硫酸____________mL
(2)配制操作可分解成如下几步,以下正确的操作顺序是_______
A. 向容量瓶中注入少量蒸馏水,检查是否漏水
B. 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C. 用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D. 根据计算,用量筒量取一定体积的浓硫酸
E. 将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F. 盖上容量瓶塞子,振荡,摇匀
G. 用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H. 继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com