
【题目】元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
A.原子序数:![]() B.离子半径:Am+>Bn-
B.离子半径:Am+>Bn-
C.原子半径:![]() D.
D.![]()
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等的方面有广泛应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合如图图像回答问题。
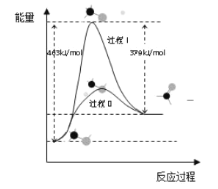
①此反应的热化学方程式是______。
②反应活化能:过程I______过程II (填“>”“=”或“<”)
③过程II温度—转化率图如图,下列说法合理的是_____。
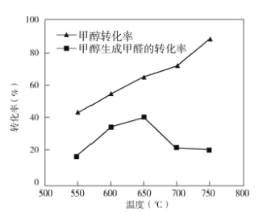
A.甲醇脱氢法制备甲醛过程无副反应发生
B.温度高于650°C催化剂烧结,活性减弱
C.及时分离产品有利于提高甲醇生成甲醛的转化率
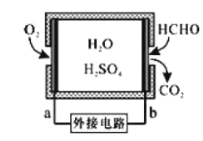
(2)甲醛超标会危害人体健康,需对甲醛往行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为_________
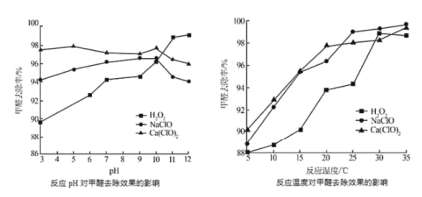
②氧化剂可处理甲醛污染,结合以如图图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为________。
(3)750K下,在恒容密闭容器中,充入的甲醇,发生反应:CH3OH(g)HCHO(g) + H2(g),若起始压强为101kPa, 达到平衡转化率为50.0%, 则反应平衡的常数Kp= ______。(用平衡分压代替平衡农度计算,分压=总压×物质的量分数,忽略其它反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
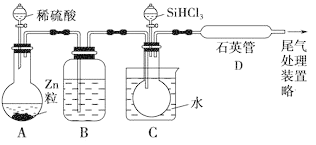
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.1000 mol·L1盐酸中滴加0.1000 mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是
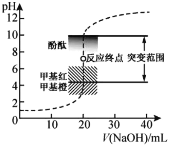
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用移液管量取20.00 mL 0.1000 mol·L1盐酸时,移液管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00 mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.68g某一元羧酸甲酯和40mL0.2molL-1的氢氧化钠溶液混合加热,使之完全水解。再用0.2molL-1 的盐酸中和剩余的烧碱,消耗盐酸15mL 。已知27.2mg该甲酯完全燃烧可得70.4mgCO2 和14.4mgH2O .求:
(1)该甲酯的最简式_______;
(2)该甲酯的相对分子质量_______;
(3)该甲酯的化学式、结构简式和名称_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修2:化学与技术]聚合硫酸铁(PFS)是水处理中重要的絮凝剂,下图是以回收废铁屑为原料制备PFS的一种工艺流程。
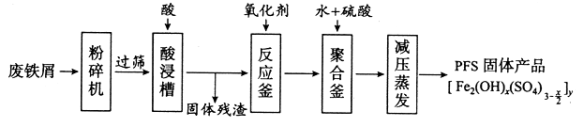
回答下列问题
(1)废铁屑主要为表面附有大量铁锈的铁,铁锈的主要成分为_________。粉碎过筛的目的是_______。
(2)酸浸时最合适的酸是_____,写出铁锈与酸反应的离子方程式_____________________。
(3)反应釜中加入氧化剂的作用是_________,下列氧化剂中最合适的是____________(填标号)。
a.KMnO4b.![]() c.
c.![]() d.
d.![]()
(4)聚合釜中溶液的pH必须控制在一定的范围内。pH偏小时Fe3+水解程度弱,pH偏大时则_______。
(5)相对于常压蒸发,减压蒸发的优点是______。
(6)盐基度B是衡量絮凝剂絮凝效果的重要指标,定义式为![]() (n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c
(n为物质的量)。为测量样品的B值,取样品mg,准确加入过量盐酸,充分反应,再加入煮沸后冷却的蒸馏水,以酚酞为指示剂,用c![]() 的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液
的标准NaOH溶液进行中和滴定(部分操作略去,已排除铁离子干扰)。到终点时消耗NaOH溶液V mL。按照上述步骤做空白对照试验,消耗NaOH溶液![]() ,已知该样品中Fe的质量分数w,则B的表达式为__________。
,已知该样品中Fe的质量分数w,则B的表达式为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com