
【题目】将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 molL1 的AgNO3溶液,乙池为1 molL1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是
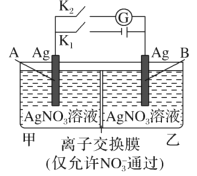
A.实验开始先断开K1,闭合K2,此时![]() 向B电极移动
向B电极移动
B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能说明SiO2为酸性氧化物的事实为( )
A.SiO2与H2SO4、HNO3不反应B.SiO2+4HF=SiF4↑+2H2O
C.SiO2+2KOH=K2SiO3+H2OD.SiO2+2C![]() Si+2CO↑
Si+2CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
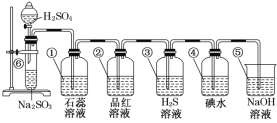
【题目】如图所示是制取SO2并验证SO2某些性质的装置图。
试回答:
(1)⑥中发生反应的化学方程式为___。
(2)①中的实验现象为___,此实验证明SO2是___氧化物。
(3)②中的品红溶液___,证明SO2有___。
(4)③中的H2S溶液____,证明SO2有___。
(5)④中的碘水___,证明SO2有____。
(6)⑤中NaOH溶液的作用是___,有关反应的化学方程式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计出如图所示装置来改进教材中“铜与硝酸反应”实验,以确保化学实验的绿色化。
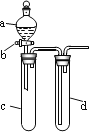
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c。其目的是_____________________________________________________________________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2 mL的浓硝酸。反应一段时间后,再由a向c中加2 mL蒸馏水,c中的实验现象有什么变化___________。
方案 | 甲 | 乙 | 丙 |
反应物 | Cu、浓HNO3 | Cu、稀HNO3 | Cu、O2、稀HNO3 |
(3)如表所示是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是__________,理由是________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
A.原子序数:![]() B.离子半径:Am+>Bn-
B.离子半径:Am+>Bn-
C.原子半径:![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO42H2O)的常用流程如图:
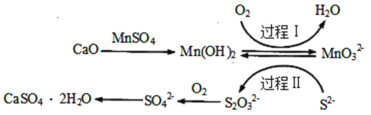
下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2
B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个
C.将10L上清液中的S2-转化为SO![]() (S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
D.过程Ⅱ中,反应的离子方程式为4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-
+4Mn(OH)2↓+10OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com