
【题目】能说明SiO2为酸性氧化物的事实为( )
A.SiO2与H2SO4、HNO3不反应B.SiO2+4HF=SiF4↑+2H2O
C.SiO2+2KOH=K2SiO3+H2OD.SiO2+2C![]() Si+2CO↑
Si+2CO↑
科目:高中化学 来源: 题型:
【题目】探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论正确的是
A.新制饱和氯水使红玫瑰变力白玫瑰,说明含有Cl2
B.加入石蕊溶液,溶液变红,说明该溶液不含HC1O
C.光照新制氯水有气泡逸出,该气体是氧气
D.向氯水中KHCO3粉末有气泡产生,说明绿水中含有HC1O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等的方面有广泛应用。
(1)甲醇脱氢法可制备甲醛(反应体系中各物质均为气态),结合如图图像回答问题。
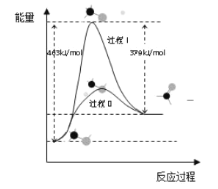
①此反应的热化学方程式是______。
②反应活化能:过程I______过程II (填“>”“=”或“<”)
③过程II温度—转化率图如图,下列说法合理的是_____。
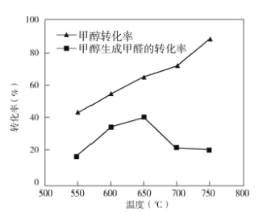
A.甲醇脱氢法制备甲醛过程无副反应发生
B.温度高于650°C催化剂烧结,活性减弱
C.及时分离产品有利于提高甲醇生成甲醛的转化率
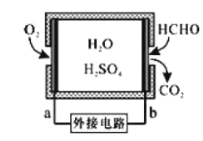
(2)甲醛超标会危害人体健康,需对甲醛往行含量检测及污染处理。
①某甲醛气体传感器的工作原理如图所示,b极的电极反应式为_________
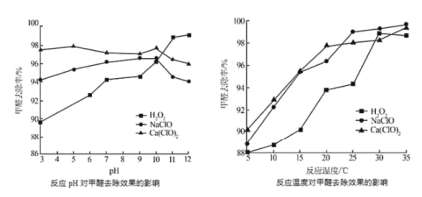
②氧化剂可处理甲醛污染,结合以如图图像分析春季(水温约15℃)应急处理甲醛污染的水源应选择的试剂为________。
(3)750K下,在恒容密闭容器中,充入的甲醇,发生反应:CH3OH(g)HCHO(g) + H2(g),若起始压强为101kPa, 达到平衡转化率为50.0%, 则反应平衡的常数Kp= ______。(用平衡分压代替平衡农度计算,分压=总压×物质的量分数,忽略其它反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________。当反应达到平衡时,若增大压强,则n(C2H4)___________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
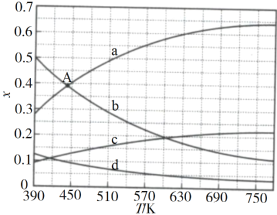
图中,表示C2H4、CO2变化的曲线分别是______、______。CO2催化加氢合成C2H4反应的ΔH______0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________(MPa)3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
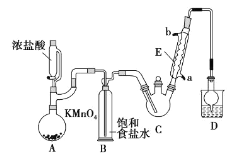
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)仪器E的名称是____,冷凝水的流向是____口进水(填“a”或“b”)。
(2)有同学认为该装置存在一处缺陷,应在BC之间加一干燥装置,理由是____。
(3)该装置C控制反应温度在70℃左右,可采用____加热的方法;
(4)装置D干燥管的作用为____,装置D烧杯中的试剂是____。
(5)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是(填名称)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
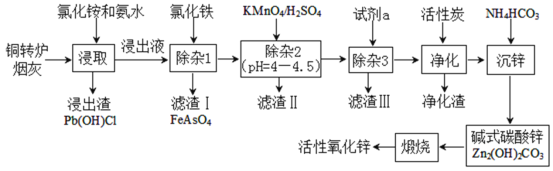
己知:活性炭净化主要是除去有机杂质。
(1)写出氯化铵的电子式___,“净化”过程属于___(填“物理”、“化学”)变化。
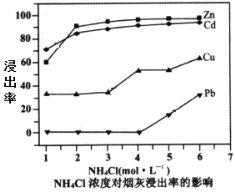
(2)在反应温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为___mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
(3)滴加KMnO4溶液有MnO2生成,目的是除___元素,除杂3是置换除杂过程,则试剂a是___,“滤渣Ⅲ”的主要成分为___(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式___,此过程中可以循环利用的副产品是___。
(5)取mg活性氧化锌样品配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
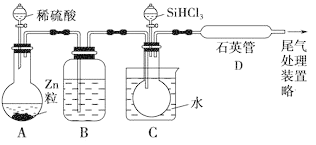
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.68g某一元羧酸甲酯和40mL0.2molL-1的氢氧化钠溶液混合加热,使之完全水解。再用0.2molL-1 的盐酸中和剩余的烧碱,消耗盐酸15mL 。已知27.2mg该甲酯完全燃烧可得70.4mgCO2 和14.4mgH2O .求:
(1)该甲酯的最简式_______;
(2)该甲酯的相对分子质量_______;
(3)该甲酯的化学式、结构简式和名称_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com