
【题目】取0.68g某一元羧酸甲酯和40mL0.2molL-1的氢氧化钠溶液混合加热,使之完全水解。再用0.2molL-1 的盐酸中和剩余的烧碱,消耗盐酸15mL 。已知27.2mg该甲酯完全燃烧可得70.4mgCO2 和14.4mgH2O .求:
(1)该甲酯的最简式_______;
(2)该甲酯的相对分子质量_______;
(3)该甲酯的化学式、结构简式和名称_______。
【答案】最简式为C4H4O 该甲酯的相对分子质量为136 化学式为C8H8O2 结构式为:![]() 名称:苯甲酸甲酯
名称:苯甲酸甲酯
【解析】
最简式可通过燃烧生成的CO2和H2O计算物质中C、H、O的物质的量的最简比可得;相对分子质量可通过水解反应计算其参与反应的物质的量,利用公式![]() 计算;利用相对分子量和最简式可知化学式,通过不饱和度和已知官能团得知结构简式和名称。
计算;利用相对分子量和最简式可知化学式,通过不饱和度和已知官能团得知结构简式和名称。
![]()
![]() ,所以一元羧酸甲酯水解消耗
,所以一元羧酸甲酯水解消耗![]() ,1mol一元羧酸甲酯与NaOH反应消耗1mol的NaOH,所以此一元羧酸甲酯摩尔质量为M=
,1mol一元羧酸甲酯与NaOH反应消耗1mol的NaOH,所以此一元羧酸甲酯摩尔质量为M=![]() =136g/mol,27.2mg甲酯物质的量为0.0002mol,完全燃烧可得70.4 mg CO2 和14.4 mg H2O,则
=136g/mol,27.2mg甲酯物质的量为0.0002mol,完全燃烧可得70.4 mg CO2 和14.4 mg H2O,则![]() ,
,![]() ,所以1mol该酯类含8molC、8molH,根据一元羧酸甲酯摩尔质量为136 g/mol,可求出含2molO所以该甲酯的分子式为C8H8O2,最简式为C4H4O;甲酯的相对分子质量数值上等于一元羧酸甲酯摩尔质量,所以甲酯的相对分子质量为136;由于该甲酯的化学式为C8H8O2,氢原子数高度不饱和,所以结构中可能含有苯环,因此结构简式为C6H5-COOCH3,名称为苯甲酸甲酯;
,所以1mol该酯类含8molC、8molH,根据一元羧酸甲酯摩尔质量为136 g/mol,可求出含2molO所以该甲酯的分子式为C8H8O2,最简式为C4H4O;甲酯的相对分子质量数值上等于一元羧酸甲酯摩尔质量,所以甲酯的相对分子质量为136;由于该甲酯的化学式为C8H8O2,氢原子数高度不饱和,所以结构中可能含有苯环,因此结构简式为C6H5-COOCH3,名称为苯甲酸甲酯;
故答案为:C4H4O;136;C8H8O2;![]() ;苯甲酸甲酯。
;苯甲酸甲酯。


科目:高中化学 来源: 题型:
【题目】能说明SiO2为酸性氧化物的事实为( )
A.SiO2与H2SO4、HNO3不反应B.SiO2+4HF=SiF4↑+2H2O
C.SiO2+2KOH=K2SiO3+H2OD.SiO2+2C![]() Si+2CO↑
Si+2CO↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素A的阳离子![]() 与元素B的阴离子
与元素B的阴离子![]() 具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
具有相同的电子层结构。以下关于A、B元素性质的比较正确的是
A.原子序数:![]() B.离子半径:Am+>Bn-
B.离子半径:Am+>Bn-
C.原子半径:![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上除去电石渣浆(含CaO)上清液中的S2-,并制取石膏(CaSO42H2O)的常用流程如图:
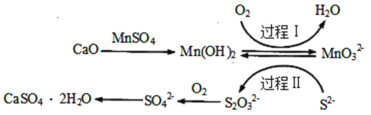
下列说法不正确的是( )
A.过程Ⅰ、Ⅱ中起催化剂作用的物质是Mn(OH)2
B.常温下,56gCaO溶于水配成1L溶液,溶液中Ca2+的数目为6.02×1023个
C.将10L上清液中的S2-转化为SO![]() (S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
(S2-浓度为320mg·L-1),理论上共需要0.2mol的O2
D.过程Ⅱ中,反应的离子方程式为4MnO![]() +2S2-+9H2O=S2O
+2S2-+9H2O=S2O![]() +4Mn(OH)2↓+10OH-
+4Mn(OH)2↓+10OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、硅酸溶液的酸性强弱顺序是:CH3COOH>H2CO3>H2SiO3
(1)利用如图所示仪器可以组装实验装置,则仪器的连接顺序为:______接_____, _____接_____,_____接_____。

(2)写出实验步骤、现象和有关的化学方程式。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】那可丁是一种药物,该药物适用于刺激性干咳病人服用,无成瘾性,化合物H是制备该药物的重要中间体,合成路线如下:
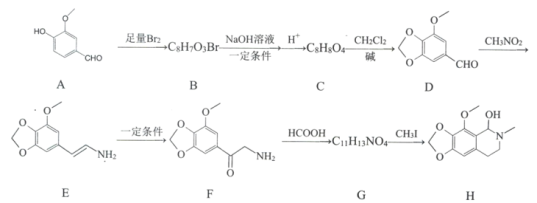
已知:①
②RNH2 ![]() RNHCH3
RNHCH3
(1)化合物B的结构简式:________。
(2)反应B→C的第一步反应类型:____________。
(3)下列说法正确的是:___________。
A 物质D能与FeCl3发生显色反应 B 物质F具有碱性
C 物质G能和银氨溶液发生反应 D 物质H的分子式是C12H15NO4
(4)写出C→D的化学方程式:____________。
(5)请写出化合物H满足下列条件的所有同分异构体的结枸简式:_______________。
①分子中含苯环,无其他环状结构
②分子中含有NO2且直接连在苯环上
③分子中只有3种不同化学环境的氢
(6)已知CH2=CHCH3![]() CH2CHCH2Cl,请以
CH2CHCH2Cl,请以![]() 、CH3CHClCH3为原料合成化合物
、CH3CHClCH3为原料合成化合物![]() ,写出制备的合成路线流程图(无机试剂任选)______________。
,写出制备的合成路线流程图(无机试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%(密度为1.84g/cm3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
(1)需要取浓硫酸____________mL
(2)配制操作可分解成如下几步,以下正确的操作顺序是_______
A. 向容量瓶中注入少量蒸馏水,检查是否漏水
B. 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C. 用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D. 根据计算,用量筒量取一定体积的浓硫酸
E. 将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F. 盖上容量瓶塞子,振荡,摇匀
G. 用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H. 继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.钠着火可以用水扑灭
B.氯气能与铁反应,所以液氯不宜贮存在钢瓶中
C.漂白粉露置于空气中会变质的反应涉及到氧化还原反应
D.FeCl3既能由金属和氯气直接反应制得,又能由金属和盐酸反应制得
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com