
【题目】设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、硅酸溶液的酸性强弱顺序是:CH3COOH>H2CO3>H2SiO3
(1)利用如图所示仪器可以组装实验装置,则仪器的连接顺序为:______接_____, _____接_____,_____接_____。

(2)写出实验步骤、现象和有关的化学方程式。_____________
【答案】A D E B C F 第一步:打开分液漏斗止水阀;现象:锥形瓶中产生气泡;化学方程式:![]() 。第二步:打开导管上的止水夹;现象:试管中产生白色沉淀;化学方程式:
。第二步:打开导管上的止水夹;现象:试管中产生白色沉淀;化学方程式:![]() 。
。
【解析】
证明三种酸的酸性强弱顺序,应运用强酸制弱酸的原理:证明醋酸酸性大于碳酸酸性,应让醋酸与碳酸钠反应;证明碳酸酸性大于硅酸酸性,应用二氧化碳与硅酸钠溶液反应,据此回答。
(1)证明三种酸的酸性强弱顺序,应运用强酸制弱酸的原理:证明醋酸酸性大于碳酸酸性,应让醋酸与碳酸钠反应故A接D;证明碳酸酸性大于硅酸酸性,应用二氧化碳与硅酸钠溶液反应,故E接B,C接F;
故答案为:A;D;E;B;C;F;
(2)第一步:醋酸制取二氧化碳;现象:锥形瓶中产生气泡;化学方程式:![]() ;
;
第二步:碳酸制取硅酸;现象:试管中产生白色沉淀;化学方程式:![]() 。
。
故答案为:第一步:打开分液漏斗止水阀;现象:锥形瓶中产生气泡;化学方程式:![]() 。第二步:打开导管上的止水夹;现象:试管中产生白色沉淀;化学方程式:
。第二步:打开导管上的止水夹;现象:试管中产生白色沉淀;化学方程式:![]() 。
。


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:
【题目】三氯乙醛是基本有机合成原料之一,是生产农药、医药的重要中间体。某化学兴趣小组设计如图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。
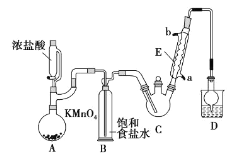
查阅资料,有关信息如下:
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应:C2H5OH+HCl→C2H5Cl+H2O、CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的相对分子质量及部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇、三氯乙醛 | 微溶于水,可溶于乙醇 |
回答下列问题:
(1)仪器E的名称是____,冷凝水的流向是____口进水(填“a”或“b”)。
(2)有同学认为该装置存在一处缺陷,应在BC之间加一干燥装置,理由是____。
(3)该装置C控制反应温度在70℃左右,可采用____加热的方法;
(4)装置D干燥管的作用为____,装置D烧杯中的试剂是____。
(5)反应结束后,从C中的混合物中分离出Cl3CCOOH的方法是(填名称)____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氮化硼、氮化铝、氮化镓的结构类似于金刚石,熔点如表中所示:
物质 | BN | AIN | GaN |
熔点/℃ | 3000 | 2200 | 1700 |
试从结构的角度分析它们熔点不同的原因___________________________________。
(2)N、P、As位于同一主族,基态氮原子的核外共有________种不同运动状态的电子,与PO43-互为等电子体的分子有________________(填一种即可)。
(3)铬原子的最高能层符号是_______,其价电子轨道表示式为____________________。
(4)比较第二电离能Cu_______Zn(填“>”、“=”、“<")。
(5)AuCl3是一种褐红色晶体,吸湿性极强,易溶于水和乙醇,无论是固态、还是气态,它都是以二聚体Au2Cl6的形式存在。写出Au2Cl6的结构式__________________________.
(6)已知Zn2+、Au+均能与CN-形成配离子, Zn2+与CN-形成的配离子为正四面体形,Au+与CN-形成的配离子为直线形. 工业上常用Au+和CN-形成的配离子与Zn单质反应来提取Au单质,写出该反应的离子方程式___________________________________________________________________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,向20.00 mL 0.1000 mol·L1盐酸中滴加0.1000 mol·L1 NaOH溶液,溶液的pH随NaOH溶液体积的变化如图,已知lg3=0.5。下列说法不正确的是
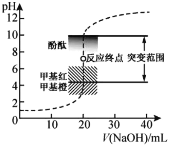
A.选择变色范围在pH突变范围内的指示剂,可减小实验误差
B.用移液管量取20.00 mL 0.1000 mol·L1盐酸时,移液管水洗后需用待取液润洗
C.NaOH标准溶液浓度的准确性直接影响分析结果的可靠性,因此需用邻苯二甲酸氢钾标定NaOH溶液的浓度,标定时采用甲基橙为指示剂
D.V(NaOH)=10.00 mL 时,pH约为1.5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有的油田开采的石油中溶有一种碳氢化合物—金刚烷。金刚烷 是一种环状烃,它的结构高度对称。下图表示金刚烷,图中数字是碳原子编号。碳原子用小黑点表示,氢原子均省略,一条短线表示共用一对电子。
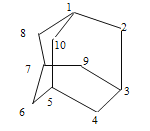
(1)编号1的碳原子上的一个氢原子被氨基(-NH2)取代后,再与盐酸反应生成盐酸盐(1—氨基金刚烷盐酸盐)是一种防治感冒的药物。推断它的化学式是__________。
(2)金刚烷是由 _____ 个六元环构成的笼形结构,其中有 _____ 个碳原子被三个环共有。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取0.68g某一元羧酸甲酯和40mL0.2molL-1的氢氧化钠溶液混合加热,使之完全水解。再用0.2molL-1 的盐酸中和剩余的烧碱,消耗盐酸15mL 。已知27.2mg该甲酯完全燃烧可得70.4mgCO2 和14.4mgH2O .求:
(1)该甲酯的最简式_______;
(2)该甲酯的相对分子质量_______;
(3)该甲酯的化学式、结构简式和名称_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法或表示方法正确的是( )
A.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8 kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(l) ΔH=-285.8 kJ·mol-1
C.Ba(OH)2·8H2O(s)+2NH4Cl(s)= BaCl2(s)+2NH3(g)+10H2O(l) ΔH<0
D.已知中和热为57.3 kJ·mol-1,若将含0.5 mol H2SO4的浓溶液与含1 mol NaOH的 稀溶液混合,则放出的热量大于57.3 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与图象对应符合的是
A.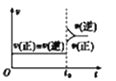 对于达到平衡状态的
对于达到平衡状态的![]()
![]() 在t0时刻充入了一定量的
在t0时刻充入了一定量的![]() ,平衡逆向移动
,平衡逆向移动
B.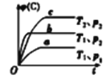 对于反应
对于反应![]() ,
,![]() ,
,![]()
C.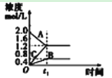 该图象表示的化学方程式为:
该图象表示的化学方程式为:![]()
D. 对于反应
对于反应![]() ,y可以表示Y的百分含量
,y可以表示Y的百分含量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化工原料水合肼(N2H4·H2O)是一种强还原性的碱性液体。
Ⅰ.实验室用下图装置制备水合肼(N2H4·H2O)。
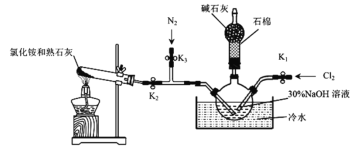
实验步骤:关闭K2、K3,打开K1,制备 NaClO;关闭K1、K2,打开K3,通入N2一段时间;关闭K3,打开K2,点燃酒精灯。回答下列问题:
(1)盛放碱石灰的仪器的名称为___________________。
(2)配制30%NaOH溶液时,所需玻璃仪器有烧杯、玻璃棒、胶头滴管和_________。
(3)步骤2中通入N2一段时间的原因是____________________________________。
(4)水槽中放入冷水的目的是_____________________________________________。
(5)NH3与 NaClO反应生成N2H4·H2O的化学方程式为_______________________。
Ⅱ.已知:N2H4·H2O+2I2=N2↑+4HI+H2O,测定水合肼粗产品的纯度步骤如下:
a.称取N2H4·H2O粗产品(其它杂质不与I2反应)2.000g。
b.加水配成250.00mL溶液。
c.移出25.00mL置于锥形瓶中,滴加几滴淀粉溶液。
d.用0.3000mol·L-1的碘标准溶液进行滴定。
e.重复上述操作两次。三次测定数据如下表:
实验序号 | 1 | 2 | 3 |
消耗碘标准溶体积/mL | 20.24 | 20.02 | 19.98 |
f.数据处理。
(6)碘标准溶液盛放在____________(填“酸式”或“碱式”)滴定管中。在滴定管中装入碘标准溶的前一步,应进行的操作为_________,达到终点的现象是__________。
(7)消耗的碘标准溶平均体积为______mL,粗产品中水合肼的质量分数为______。
(8)判断下列操作对测定结果的影响(填“偏高”、“偏低”或“无影响”)。
①若在配制碘标准溶液时,烧杯中的溶液有少量溅出,则测定结果___________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,则测定结果___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com