
【题目】下列叙述与图象对应符合的是
A.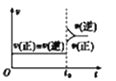 对于达到平衡状态的
对于达到平衡状态的![]()
![]() 在t0时刻充入了一定量的
在t0时刻充入了一定量的![]() ,平衡逆向移动
,平衡逆向移动
B.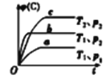 对于反应
对于反应![]() ,
,![]() ,
,![]()
C.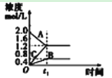 该图象表示的化学方程式为:
该图象表示的化学方程式为:![]()
D. 对于反应
对于反应![]() ,y可以表示Y的百分含量
,y可以表示Y的百分含量
【答案】B
【解析】
A.对于达到平衡状态的N2(g)+3H2(g)2NH3(g)在t0时刻充入了一定量的NH3,c(NH3)立即增大,故V逆立即增大,由于反应物的浓度是在原来基础上逐渐增大,故V正在原来基础上逐渐增大,不会出现突变,故A错误;
B.根据“定一议二”的原则,将曲线a和b做对比可知压强p2>p1,将曲线b和c做对比可知温度T1>T2,故B正确;
C.根据图象可知,A为反应物,B和C为生成物,在t1时反应达平衡,A、B、C的浓度该变量分别为0.8mol/L、0.4mol/L和1.2mol/L,故A、B、C的计量数之比为2∶1∶3,由于此反应最后达平衡,故为可逆反应,故化学方程式为:2AB+3C,故C错误;
D.从图象可知,温度T升高,y降低。而对于反应2X(g)+3Y(g)2Z(g)△H<0,升高温度,平衡左移,Y的百分含量升高,故y不能表示Y的百分含量,故D错误;
故选B。


 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计一个简单的一次性完成实验的装置图,验证醋酸溶液、二氧化碳水溶液、硅酸溶液的酸性强弱顺序是:CH3COOH>H2CO3>H2SiO3
(1)利用如图所示仪器可以组装实验装置,则仪器的连接顺序为:______接_____, _____接_____,_____接_____。

(2)写出实验步骤、现象和有关的化学方程式。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%(密度为1.84g/cm3)的浓硫酸稀释成3mol/L的稀硫酸100mL,回答下列问题:
(1)需要取浓硫酸____________mL
(2)配制操作可分解成如下几步,以下正确的操作顺序是_______
A. 向容量瓶中注入少量蒸馏水,检查是否漏水
B. 用少量蒸馏水洗涤烧杯及玻璃棒,将溶液注入容量瓶,并重复操作两次
C. 用已冷却的稀硫酸注入已检查不漏水的容量瓶中
D. 根据计算,用量筒量取一定体积的浓硫酸
E. 将浓硫酸沿烧杯壁慢慢注入盛有蒸馏水的小烧杯中,并不断用玻璃棒搅拌
F. 盖上容量瓶塞子,振荡,摇匀
G. 用胶头滴管滴加蒸馏水,使溶液凹面恰好与刻度相切
H. 继续往容量瓶中小心地加蒸馏水,使液面接近刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z,它们在周期表中位置如图所示,X的一种氢化物与其最高价氧化物对应水化物反应生成盐。下列说法正确的是
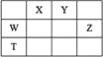
A. X的氢化物的沸点一定低于同主族元素形成的其他氢化物
B. 由Y、Z和氢三种元素形成的化合物中,Z的化合价越高氧化性越强
C. W的氧化物是酸性氧化物,能与碱、水反应,不能与酸反应
D. T元素单质具有半导体的特性,T与Y元素可形成两种化合物TY和![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Weiss利用光敏剂QD制备2-环己基苯乙烯(c)的过程如图所示,下列有关说法正确
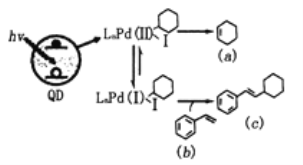
A.a中所有碳原子都在同一个平面上B.b既能发生氧化反应也能发生还原反应
C.b有共轭双键,能发生1,4-加成D.b、c是同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请回答有关问题:
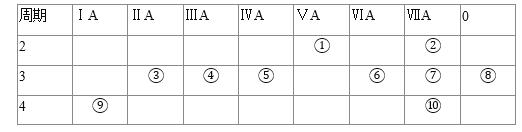
(1)①和⑤的元素符号是 ______ 和 ______ .
(2)表中最活泼的金属是 ______ ,非金属性最强的元素是 ______ ![]() 填写元素符号
填写元素符号![]()
(3)表中能形成两性氢氧化物的元素是 ______ ![]() 填写元素符号
填写元素符号![]() ,分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式: ______ , ______ .
,分别写出该元素的氢氧化物与⑥⑨最高价氧化物的水化物反应的化学方程式: ______ , ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
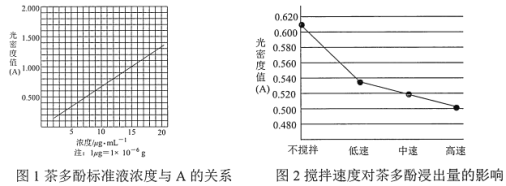
【题目】茶叶中的茶多酚是一种天然抗氧化剂(其抗氧化能力是 VC 的 5~10 倍),它易溶于水、乙醇、乙酸乙酯,难溶于氯仿。在酸性介质中,茶多酚能将 Fe3+还原为 Fe2+,Fe2+与 K3Fe(CN)6生成的深蓝色配位化合物 KFe[Fe(CN)6]对特定波长光的吸收程度(用光密度值 A 表示)与茶多酚在一定浓度范围内成正比。A 与茶多酚标准液浓度的关系如图 1 所示:
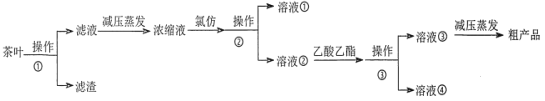
某实验小组设计如下实验流程从茶叶中提取茶多酚:
请回答下列问题:
(1)操作①用水浸取茶多酚时,实验小组发现搅拌速度对茶多酚浸出量的影响如图 2 所示,原因是____。若用乙醇浸取茶多酚操作如下:称取 10 g 茶叶末,用滤纸包好,装入恒压滴液漏斗中,圆底烧瓶内加沸石和适量乙醇,如图 3 安装后, 通冷凝水,加热套加热,当乙醇被加热沸腾后,控制加热套温度在 90℃。为使恒压漏斗内液面高出茶叶包约 0.5 cm,并保持约 1 h,可行的操作方法是________。
(2)减压蒸发相对于一般蒸发的优点是________;氯仿的作用是________。
(3)下列有关实验基本操作不正确的是________。
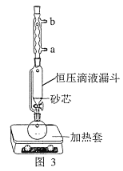
A.图 3 中冷凝水流向为 a 进 b 出
B.分液漏斗使用前须检验是否漏水并洗净备用
C.操作①过滤时,可用玻璃棒适当搅拌以加快分离速度
D.萃取过程中,经振摇并放气后,将分液漏斗置于铁圈上立即分液
(4)称取 1.25 g 粗产品,用蒸馏水溶解并定容至 1000 mL,移取该溶液 1.00 mL,加过量 Fe3+和 K3Fe(CN)6 酸性溶液,用蒸馏水定容至 100 mL 后,测得溶液光密度值 A=0.800,则产品的纯度是_____ (以质量分数表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com