
【题目】如图所示是制取SO2并验证SO2某些性质的装置图。
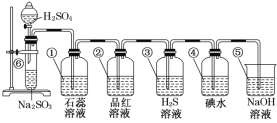
试回答:
(1)⑥中发生反应的化学方程式为___。
(2)①中的实验现象为___,此实验证明SO2是___氧化物。
(3)②中的品红溶液___,证明SO2有___。
(4)③中的H2S溶液____,证明SO2有___。
(5)④中的碘水___,证明SO2有____。
(6)⑤中NaOH溶液的作用是___,有关反应的化学方程式为____。
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 溶液变红 酸性 褪色 漂白性 出现浅黄色沉淀(或变浑浊) 氧化性 褪色 还原性 吸收多余的SO2,防止其污染环境 2NaOH+SO2=Na2SO3+H2O
【解析】
浓硫酸和亚硫酸钠反应生成二氧化硫气体,通入石蕊,使石蕊变红,再通入品红,品红褪色,再通入氢硫酸中,溶液变浑浊,再通入碘水,溶液褪色,再通入氢氧化钠溶液,处理尾气,防止污染环境。
①⑥中发生反应的化学方程式为Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,故答案为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
⑵①中的实验现象为溶液变红,说明亚硫酸使石蕊变红,此实验证明SO2是酸性氧化物,故答案为:溶液变红;酸性。
⑶②中的品红溶液褪色,证明SO2有漂白性,故答案为:褪色;漂白性。
⑷③中的H2S溶液出现浅黄色沉淀(或变浑浊),二氧化硫中硫元素化合价降低,H2S中硫元素化合价升高,证明SO2有氧化性,故答案为:出现浅黄色沉淀(或变浑浊);氧化性。
⑸④中的碘水褪色,碘水和二氧化硫反应生成氢碘酸和硫酸,二氧化硫中硫元素化合价升高,证明SO2有还原性,故答案为:褪色;还原性。
⑹⑤中NaOH溶液的作用是吸收多余的SO2,防止其污染环境,有关反应的化学方程式为2NaOH+SO2=Na2SO3+H2O,故答案为:吸收多余的SO2,防止其污染环境;2NaOH+SO2=Na2SO3+H2O。


科目:高中化学 来源: 题型:
【题目】无色的混合气体甲,可能含NO、CO2、NO2、N2中的几种,将一定量的甲气体经过如图实验的处理,结果得到酸性溶液,而几乎无气体剩余,则甲气体的组成为( )

A.NO2、N2B.NO、CO2
C.NO2、CO2D.NO、CO2、N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳催化加氢合成乙烯是综合利用CO2的热点研究领域。回答下列问题:
(1)CO2催化加氢生成乙烯和水的反应中,产物的物质的量之比n(C2H4)∶n(H2O)=__________。当反应达到平衡时,若增大压强,则n(C2H4)___________(填“变大”“变小”或“不变”)。
(2)理论计算表明,原料初始组成n(CO2)∶n(H2)=1∶3,在体系压强为0.1MPa,反应达到平衡时,四种组分的物质的量分数x随温度T的变化如图所示。
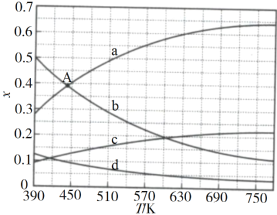
图中,表示C2H4、CO2变化的曲线分别是______、______。CO2催化加氢合成C2H4反应的ΔH______0(填“大于”或“小于”)。
(3)根据图中点A(440K,0.39),计算该温度时反应的平衡常数Kp=_________(MPa)3(列出计算式。以分压表示,分压=总压×物质的量分数)。
(4)二氧化碳催化加氢合成乙烯反应往往伴随副反应,生成C3H6、C3H8、C4H8等低碳烃。一定温度和压强条件下,为了提高反应速率和乙烯选择性,应当___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜转炉烟灰主要含有Zn[还有少量的Fe(+2价)、Pb、Cu、As等元素]的硫酸盐和氧化物,少量为砷酸盐。制备重要化工原料活性氧化锌的工艺流程如图所示。请回答以下问题:
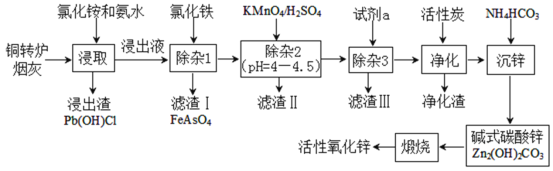
己知:活性炭净化主要是除去有机杂质。
(1)写出氯化铵的电子式___,“净化”过程属于___(填“物理”、“化学”)变化。
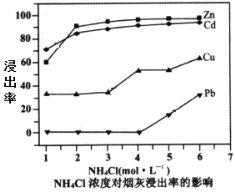
(2)在反应温度为50℃,反应时间为1h时,测定各元素的浸出率与氯化铵溶液浓度的关系如图,则氯化铵适宜的浓度为___mol·L-1。若浸出液中锌元素以[Zn(NH3)4]2+形式存在,则浸取时ZnO发生反应的离子方程式为___。
(3)滴加KMnO4溶液有MnO2生成,目的是除___元素,除杂3是置换除杂过程,则试剂a是___,“滤渣Ⅲ”的主要成分为___(填化学式)。
(4)写出“沉锌”时发生反应的离子方程式___,此过程中可以循环利用的副产品是___。
(5)取mg活性氧化锌样品配成待测液,加入指示剂3、4滴,再加入适量六亚甲基四胺,用amolL-1EDTA标准液进行滴定,消耗标准液VmL。己知:与1.0mLEDTA标准液[c(EDTA)=1.000mo1L-1]相当的以克表示的氧化锌质量为0.08139,则样品中氧化锌的质量分数为___(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅已知SiHCl3能与H2O强烈反应,在空气中易自燃。
请回答下列问题:
(1)第①步制备粗硅的化学方程式为_____________________________________________。
(2)粗硅与HCl反应完全后,经冷凝得到的SiHCl3(沸点33.0 ℃)中含有少量SiCl4(沸点57.6 ℃)和HCl(沸点-84.7 ℃),提纯SiHCl3采用的方法为___________________________。
(3)用SiHCl3与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):
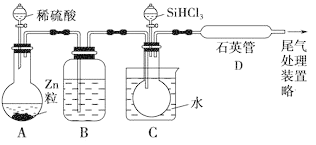
①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是________________________________________________________________。
②反应一段时间后,装置D中观察到的现象是________,装置D不能采用普通玻璃管的原因是____________,装置D中发生反应的化学方程式为_____________________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下对反应的化学方程式,并注明反应类型:
(1)乙醇制乙烯:__,反应类型:__。
(2)乙醇与浓氢溴酸反应:__,反应类型__。
(3)苯酚与浓溴水反应:__,反应类型__。
(4)乙醛与新制氢氧化铜悬浊液反应:__,反应类型__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别与过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.生成气泡快慢:两者相同
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图Ⅰ是NO2(g)+CO(g) ![]() CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。
CO2(g)+NO(g)反应过程中能量变化的示意图。一定条件下,在固定容积的密闭容器中该反应达到平衡状态。当改变其中一个条件X,Y随X的变化关系曲线如图Ⅱ所示。

下列有关说法正确的是
A. 一定条件下,向密闭容器中加入1 mol NO2(g)与1 mol CO(g)反应放出234 kJ热量
B. 若X表示CO的起始浓度,则Y表示的可能是NO2的转化率
C. 若X表示温度,则Y表示的可能是CO2的物质的量浓度
D. 若X表示反应时间,则Y表示的可能是混合气体的密度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224L氯化氢气体溶于635mL的水(密度为1 g/cm-3)中,所得盐酸的密度为1.18g/cm3。
(1)该盐酸的质量分数是_________
(2)取这种盐酸10mL,稀释到1.45L,所得的稀盐酸的物质的量浓度________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com