
【题目】已知如图中H是无色液体,号称生命之源,B是空气中含量最多的物质,E是红棕色气体。
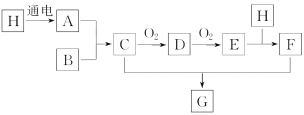
(1)C的化学式是___。
(2)D和E都是大气污染物,D转化成E的化学方程式是___。
(3)E和H的反应中,氧化剂和还原剂的质量比是___。
【答案】NH3 NO+O2=2NO2 1∶2
【解析】
H是无色液体,号称生命之源,推断为H2O,B是空气中含量最多的物质为N2,E是红棕色气体,经过两步氧化得到判断为NO2,结合流程图分析可知,H为H2O,A为H2,B为空气中的N2,C为NH3,D为NO,E为NO2,E和水反应生成硝酸和一氧化氮,C+F=G,是NH3+HNO3=NH4NO3,依据判断的物质回答问题。
H是无色液体,号称生命之源,推断为H2O,B是空气中含量最多的物质为N2,E是红棕色气体,经过两步氧化得到判断为NO2,结合流程图分析可知,H为H2O,A为H2,B为空气中的N2,C为NH3,D为NO,E为NO2,E和水反应生成硝酸和一氧化氮,C+F=G,是NH3+HNO3=NH4NO3;
(1)C的化学式为NH3;
(2)D和E都是大气污染物,NO转化为NO2的化学方程式分别是2NO+O2=2NO2;
(3)E和H反应为3NO2+H2O=2HNO3+NO,依据元素化合价变化分析可知,一氧化氮为还原产物,硝酸为氧化产物,所以氧化剂和还原剂的质量比是1:2。


 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:

(1)仪器a的名称为______;仪器b中可选择的试剂为______。
(2)实验室中,利用装置A,还可制取的无色气体是______(填字母)。
A.Cl2 B.O2 C.CO2 D.NO2
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有______性,写出相应的化学方程式______。
(4)E装置中浓硫酸的作用______。
(5)读取气体体积前,应对装置F进行的操作:______。
(6)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为n L(已折算成标准状况),则氨分子中氮、氢的原子个数比为______(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
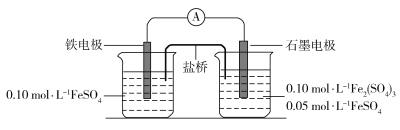
回答下列问题:
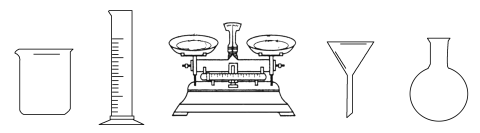
(1)由FeSO4·7H2O固体配制0.10 mol·L1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_________(从下列图中选择,写出名称)。
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择____________作为电解质。
阳离子 | u∞×108/(m2·s1·V1) | 阴离子 | u∞×108/(m2·s1·V1) |
Li+ | 4.07 |
| 4.61 |
Na+ | 5.19 |
| 7.40 |
Ca2+ | 6.59 | Cl | 7.91 |
K+ | 7.62 |
| 8.27 |
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_______,铁电极的电极反应式为_______。因此,验证了Fe2+氧化性小于________,还原性小于________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钙钛矿(CaTiO3)型化合物是一类可用于生产太阳能电池、传感器、固体电阻器等的功能材料,回答下列问题:
(1)基态Ti原子的核外电子排布式为____________。
(2)Ti的四卤化物熔点如下表所示,TiF4熔点高于其他三种卤化物,自TiCl4至TiI4熔点依次升高,原因是____________。
化合物 | TiF4 | TiCl4 | TiBr4 | TiI4 |
熔点/℃ | 377 | ﹣24.12 | 38.3 | 155 |
(3)CaTiO3的晶胞如图(a)所示,其组成元素的电负性大小顺序是__________;金属离子与氧离子间的作用力为__________,Ca2+的配位数是__________。
(4)一种立方钙钛矿结构的金属卤化物光电材料的组成为Pb2+、I﹣和有机碱离子![]() ,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱
,其晶胞如图(b)所示。其中Pb2+与图(a)中__________的空间位置相同,有机碱![]() 中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
中,N原子的杂化轨道类型是__________;若晶胞参数为a nm,则晶体密度为_________g·cm-3(列出计算式)。
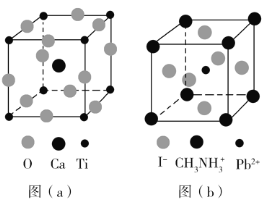
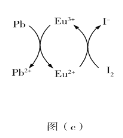
(5)用上述金属卤化物光电材料制作的太阳能电池在使用过程中会产生单质铅和碘,降低了器件效率和使用寿命。我国科学家巧妙地在此材料中引入稀土铕(Eu)盐,提升了太阳能电池的效率和使用寿命,其作用原理如图(c)所示,用离子方程式表示该原理_______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年北京奥运会主体育场“鸟巢”,被《泰晤士报》评为全球“最强悍”工程。“鸟巢”运用了高强度、高性能的钒氮合金高新钢和884 块ETFE 膜,并采用新一代的氮化镓铟高亮度LED材料。有关说法正确的是

A.合金的熔点通常比组分金属高,硬度比组分金属小
B.已知Ga 处于IIIA 族,可推知氮化镓化学式为GaN
C.用金属铝与V2O5反应冶炼钒,V2O5作还原剂
D.ETFE 膜(![]() )是由一种单体加聚而成的
)是由一种单体加聚而成的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当电解质中某离子的浓度越大时,其氧化性或还原性越强,利用这一性质,有人设计出如图所示“浓差电池”(其电动势取决于物质的浓度差,是由一种物质从高浓度向低浓度转移而产生的。)其中,甲池为3 molL1 的AgNO3溶液,乙池为1 molL1的AgNO3溶液,A、B均为Ag 电极。实验开始先断开K1闭合K2发现电流计指针发生偏转。下列说法不正确的是
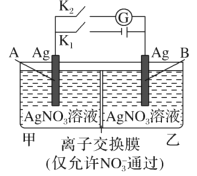
A.实验开始先断开K1,闭合K2,此时![]() 向B电极移动
向B电极移动
B.断开K1,闭合K2,一段时间后电流计指针归零,此时两池银离子浓度相等
C.当电流计指针归零后,断开K2闭合K1一段时间后B电极的质量增加
D.当电流计指针归零后,断开K2闭合K1,乙池溶液浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭的2 L容器中装有4 mol SO2和2 mol O2,在一定条件下开始反应。2 min末测得容器中有1.6 mol SO2,请计算:
(1)2 min末SO3的浓度;
(2)2 min内SO2的平均反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喷泉实验装置如图所示。应用下列各组气体—溶液,能出现喷泉现象的是
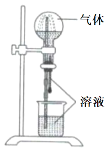
气体 | 溶液 | |
A. | H2S | 稀盐酸 |
B. | HCl | 稀氨水 |
C. | NO | 稀H2SO4 |
D. | CO2 | 饱和NaHCO3溶液 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向溴水中加入足量乙醛溶液,可以看到溴水褪色。据此对溴水与乙醛发生的有机反应类型进行如下探究,请你完成下列填空:
Ⅰ.猜测:
(1)溴水与乙醛发生取代反应;
(2)溴水与乙醛发生加成反应;
(3)溴水与乙醛发生___反应。
Ⅱ.设计方案并论证:
为探究哪一种猜测正确,某研究性学习小组提出了如下两种实验方案:
方案1:检验褪色后溶液的酸碱性。
方案2:测定反应前用于溴水制备的Br2的物质的量和反应后Br-离子的物质的量。
(1)方案1是否可行?___?理由是___。
(2)假设测得反应前用于溴水制备的Br2的物质的量为amol,
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生加成反应;
若测得反应后n(Br-)=___mol,则说明溴水与乙醛发生取代反应;
若测得反应后n(Br-)=___mol,则说明猜测(3)正确。
Ⅲ.实验验证:某同学在含0.005molBr2的10mL溶液中,加入足量乙醛溶液使其褪色;再加入过量AgNO3溶液,得到淡黄色沉淀1.88g(已知反应生成有机物与AgNO3不反应)。根据计算结果,推知溴水与乙醛反应的离子方程式为___。
Ⅳ.拓展:
请你设计对照实验,探究乙醛和乙醇的还原性强弱(填写下表)。
实验操作步骤 | 实验现象 | 结论 |
___ | ___ | ___ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com