
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
![]()
其中第①步存在平衡步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显________色。
(2)写出第③步的离子反应方程式:__________。
(3)第②步中,用6mol的FeSO4·7H2O可还原________molCr2O72-离子。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)写出阳极的电极反应式___________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为____________。
【答案】(1)黄;
(2)Cr3++3OH-=Cr(OH)3↓;
(3)1;(4)5;
(5)Fe-2e-=Fe2+;
(6)2H++2e-=H2↑;
(7)Zn2++2e-=Zn。
【解析】
试题分析:(1)c(H+)减小,平衡2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O左移,溶液呈黄色,故答案为:黄;
Cr2O72-(橙色)+H2O左移,溶液呈黄色,故答案为:黄;
(2)第③步是沉淀铬离子的反应,离子反应方程式为Cr3++3OH-=Cr(OH)3↓,故答案为:Cr3++3OH-=Cr(OH)3↓;
(3)6mol亚铁离子被氧化为+3价,失去6mol电子,Cr2O72-离子中铬元素化合价从+6价降低到+3价,应该得到6mol电子,所以6mol的FeSO4·7H2O可还原1mol Cr2O72-离子,故答案为:1;
(4)Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,则需c(OH-)=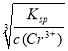 =
=![]() =10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
=10-9mol/L,所以c(H+)=10-5mol/L,即pH=5,故答案为:5;
(5)在电解法除铬中,铁作阳极,阳极反应为Fe-2e-═Fe2+,以提供还原剂Fe2+,故答案为:Fe-2e-=Fe2+;
(6)在阴极附近溶液pH升高的原因是水电离产生的H+放电生成H2:2H++2e-═H2↑;故答案为:2H++2e-=H2↑;
(7)用电镀法在铁制品上镀上一层锌,阴极上的电极反应式为Zn2++2e-=Zn,故答案为:Zn2++2e-=Zn。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】在铁和铜的混合物中,加入不足量的稀硝酸,反应后剩余金属m1g;再向其中加入一定量的稀硫酸,充分振荡后 ,剩余金属m2g,则m1和 m2之间的关系是( )
A.m1一定大于m2 B.m1 可能等于m2
C.m1一定等于m2 C.m1 可能大于m2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届江苏苏中三市二调】工业上曾经通过反应“3Fe+4NaOH![]() Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
Fe3O4+2H2↑+4Na↑”生产金属钠。下列有关说法正确的是
A.用磁铁可以将Fe与Fe3O4分离
B.将生成的气体在空气中冷却可获得钠
C.该反应条件下铁的氧化性比钠强
D.每生成1molH2,转移的电子数约为4×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 (15分)研究证明,高铁酸钾不仅能在饮用水源和废水处理过程中去除污染物,而且不产生任何诱变致癌的产物,具有高度的安全性。湿法制备高铁酸钾是目前最成熟的方法,实验步骤如下:
A.直接用天平称取60.5gFe(NO3)3·9H2O、30.0gNaOH、17.1gKOH。
B.在冰冷却的环境中向NaClO溶液中加入固体NaOH并搅拌,又想其中缓慢少量分批加入Fe(NO3)3·9H2O,并不断搅拌。C.水浴温度控制在20℃,用电磁加热搅拌器搅拌1.5h左右,溶液成紫红色时,即表明有Na2FeO4生成。
D.在继续充分搅拌的情况下,向上述的反应液中加入固体NaOH至饱和。
e.将固体KOH加入到上述溶液中至饱和。保持温度在20℃,并不停的搅拌15min,可见到烧杯壁有黑色沉淀物生成,即K2FeO4.
(1)①步骤b中不断搅拌的目的是_______。②步骤c中发生反应的离子方程式为______。③由以上信息可知:高铁酸钾的溶解度比高铁酸钠_______(填“大”或“小”)。
(2) 高铁酸钾是一种理想的水处理剂,与水反应生成O2、Fe(OH)3(胶体)和KOH。① 该反应的离子方程式为______。②高铁酸钾作为水处理剂发挥的作用是_______。③ 在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用_______。
A.H2O B.稀KOH溶液、异丙醇 C.NH4Cl溶液、异丙醇 D.Fe(NO3)3溶液、异丙醇
(3) 高铁酸钠还可以用电解法制得,其原理可表示为Fe+2NaOH+2H2O![]() 3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
3H2↑+Na2FeO4,则阳极材料是____,电解液为______。
(4)25℃时,Ksp(CaFeO4)=4.536×10-9,若要使100mL1.0×10-3mol/L的K2FeO4溶液中的c(FeO42-)完全沉淀,理论上要加入Ca(OH)2的物质的量为_____mol。
(5)干法制备高铁酸钾的方法是Fe2O3、KNO3、KOH混合加热共熔生成黑色高铁酸钾和KNO2等产物。则该方法中氧化剂与还原剂的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用含有杂质(FeO、Fe2O3)的废CuO制备胆矾晶体,经历了下列过程(已知Fe3+在pH=5时沉淀完全)。其中分析错误的是

A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B.步骤②可用氯水、硝酸等强氧化剂代替H2O2
C.步骤③用CuCO3代替CuO也可调节溶液的pH
D.步骤⑤的操作为:向漏斗中加人少量冷的蒸馏水至浸没晶体,待水自然流下,重复操作2~3次
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于水的电离平衡叙述不正确的是( )
A.将水加热,pH减小
B.恒温下,向水中加入少量固体KOH,Kw不变
C.向水中加入金属钠,c(H+)减小
D.向水中通入氯化氢气体,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,下列溶液的pH值最小的是
A. 0.01mol·L-1HCl
B. pH=2的H2SO4溶液
C. c(OH)=10-13 mol·L-1
D. pH=1溶液加水稀释1倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是( )
A. 食盐、淡水 B. 钠、镁 C. 烧碱、氯气 D. 溴、碘
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com