
【题目】 海水资源的综合利用十分重要,不需要通过化学变化就能够从海水中获得的物质是( )
A. 食盐、淡水 B. 钠、镁 C. 烧碱、氯气 D. 溴、碘
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:
【题目】某些电镀厂的酸性废水中常含有一定量的CrO42-和Cr2O72-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有两种。
方法1:还原沉淀法,该法的工艺流程为:
![]()
其中第①步存在平衡步存在平衡:2CrO42-(黄色)+2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
(1)若平衡体系的pH=12,该溶液显________色。
(2)写出第③步的离子反应方程式:__________。
(3)第②步中,用6mol的FeSO4·7H2O可还原________molCr2O72-离子。
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) ![]() Cr3+(aq)+3OH-(aq)
Cr3+(aq)+3OH-(aq)
常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至_______。
方法2:电解法:该法用Fe做电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3沉淀。
(5)写出阳极的电极反应式___________________。
(6)在阴极附近溶液pH升高的原因是(用电极反应解释)__________________________
(7)用电镀法在铁制品上镀上一层锌,则阴极上的电极反应式为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将过量的CO2分别通入①NA2SiO3溶液; ②CACl2溶液 ③CA(ClO)2溶液 ④饱和NA2CO3 溶液,最终溶液中有白色沉淀析出得是
A.①②③④ B.①④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】额度图有机物分子中带“*”碳原子是手性碳原子。该有机物分别发生下列反应,生成的有机物分子中不会含有手性碳原子的是
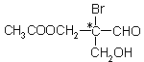
①与甲酸发生酯化反应
②与足量NaOH水溶液反应
③与银氨溶液作用只发生银镜反应
④催化剂作用下与H2反应
A、①②③④ B、①③ C、②④ D、以上反应都不成立
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色溶液中可能含有Na+、K+、NH4+、Mg2+、Cu2+、SO42-、SO32-、Cl-、Br-、CO32-中的若干种,离子浓度都为0.1mol·L-1。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如下实验:

则关于原溶液的判断不正确的是
A.若步骤中Ba(NO3)2和HNO3溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
B.无法确定原溶液中是否存在Cl-
C.肯定存在的离子是SO32-、Br-,是否存在Na+、K+需要通过焰色反应来确定
D.肯定不存在的离子是Mg2+、Cu2+、SO42-、CO32-,是否含NH4+另需实验验证
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法能达到目的的是
A.用氨水除去试管内壁上的银镜
B.用分液的方法分离乙酸乙酯和乙醇的混合物
C.用点燃的方法鉴别乙醇、苯和四氯化碳
D.用溴水鉴别苯、甲苯和乙苯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市对大气进行检测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5um的悬浮颗粒物)其主要来源为燃烧、机动车尾气等。因此,对PM2.5、SO2、NO等进行研究具有重要意义。回答下列问题:
(1)已知:①CH4(g)+2O2(g)=CO2(g)+2H2O(l) H=-890.3KJ/mol
②N2(g)+O2(g)=2NO(g) H=+180KJ/mol
CH4可用于燃烧脱硝,CH4(g)+4NO(g)=CO2(g)+2N2(g)+2H2O(l) H=_______________。
(2)汽车尾气中NOx和CO的生成及转化
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g) H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
2NO(g) H>0。汽车启动后,气缸温度较高,单位时间内NO排放量越大,原因是_______________________。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO;2CO(g)=2C(s)+O2(g)已知反应的H>0,简述该设想能否实现的依据_______________________。
③目前,在汽车尾气系统中安装催化转化器可减少CO和NO的污染,其化学方程式为_______________。
(3)一定温度下,在密闭容器中反应2NO2(g) ![]() N2O4(g) H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
N2O4(g) H=-57.20KJ/mol达到平衡。其他条件不变时,下列措施能提高NO2转化率的是____________(填字母)
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度 D.升高温度
在一定温度和压强下,密闭容器中N2O4和NO2的混合气体达到平衡时,c(N2O4)=0.0120mol/L(已知2NO2(g) ![]() N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
N2O4(g)反应在该温度下的平衡常数K=40/3)。计算平衡时 NO2物质的量浓度为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com