
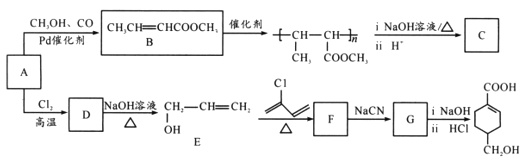
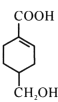
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和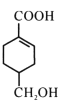 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。
已知: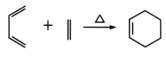 ,
,![]() RCOOH
RCOOH
(1) 发生缩聚形成的高聚物的结构简式为____;D→E的反应类型为____。
发生缩聚形成的高聚物的结构简式为____;D→E的反应类型为____。
(2)E→F的化学方程式为____。
(3)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是____(写出结构简式)。
(4)等物质的量的 分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为____;检验
分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为____;检验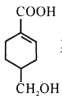 的碳碳双键的方法是____(写出对应试剂及现象)。
的碳碳双键的方法是____(写出对应试剂及现象)。
【答案】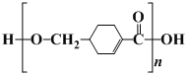 取代反应
取代反应 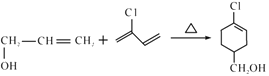
![]() 1:1 加入溴水,溴水褪色
1:1 加入溴水,溴水褪色
【解析】
B的结构简式为CH3CH=CHCOOCH3,A的分子式为C3H6,A是基本有机化工原料,A与CH3OH、CO在Pd催化剂作用下反应生成B,则A结构简式为CH2=CHCH3;![]() 发生水解反应然后酸化得到聚合物C,C的结构简式为
发生水解反应然后酸化得到聚合物C,C的结构简式为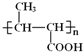 ;A与Cl2高温下反应生成D,D发生水解反应生成E,根据E的结构简式推知D为CH2=CHCH2Cl;E与
;A与Cl2高温下反应生成D,D发生水解反应生成E,根据E的结构简式推知D为CH2=CHCH2Cl;E与![]() 发生题给信息的加成反应生成F,结合结构简式
发生题给信息的加成反应生成F,结合结构简式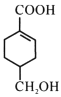 ,F结构简式为
,F结构简式为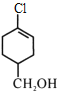 ,F发生取代反应生成G,G发生信息中反应得到
,F发生取代反应生成G,G发生信息中反应得到 ,则G结构简式为
,则G结构简式为![]() ,以此来解答。
,以此来解答。
(1) 含有羧基和醇羟基,能发生缩聚生成聚合酯,所得高聚物的结构简式为
含有羧基和醇羟基,能发生缩聚生成聚合酯,所得高聚物的结构简式为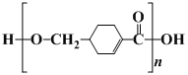 ;D→E是卤代烃的水解,反应类型是取代反应;
;D→E是卤代烃的水解,反应类型是取代反应;
(2) E→F的化学方程式为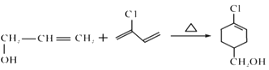 ;
;
(3) B结构简式为CH3CH=CHCOOCH3,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是![]() ;
;
(4) 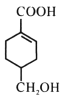 分子结构中含有羧基和醇羟基,只有羧基能与NaOH、NaHCO3反应,等物质的量的
分子结构中含有羧基和醇羟基,只有羧基能与NaOH、NaHCO3反应,等物质的量的  分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为1:1;检验碳碳双键可用溴水或酸性高锰酸钾溶液,但由于醇羟基也能使酸性高锰酸钾溶液褪色,所以向
分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为1:1;检验碳碳双键可用溴水或酸性高锰酸钾溶液,但由于醇羟基也能使酸性高锰酸钾溶液褪色,所以向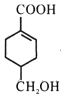 中滴加溴水,溴水褪色,即说明
中滴加溴水,溴水褪色,即说明 含有碳碳双键。
含有碳碳双键。


科目:高中化学 来源: 题型:
【题目】中药狼把草的成分之一M具有消炎杀菌作用,M的结构如图所示。下列叙述正确的是( )
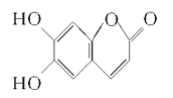
A. M的相对分子质量是180
B. 1 mol M最多能与2 mol Br2发生反应
C. M与足量的NaOH溶液发生反应时,所得有机产物的化学式为C9H4O5Na4
D. 1 mol M与足量NaHCO3反应能生成2 mol CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体CO2的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一。
已知:①H2和CH4的燃烧热分别为285.5kJ/mol和890.0kJ/mol。
②H2O(1)=H2O(g) ΔH=+44kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式__。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1=__,此时n2=3.则反应I的平衡常数Kp=__(无需带单位,用含总压p的式子表示。已知:气体各组分的分压p(B),等于总压乘以其体积分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。

(4)用活性炭还原法可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是__填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
F.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-选修2:化学与技术]
双氧水是一种重要的氧化剂、漂白剂和消毒剂。生产双氧水常采用蒽醌法,其反应原理和生产流程如图所示:


A.氢化釜 | B.过滤器 | C.氧化塔 | D.萃取塔E.净化塔F.工作液再生装置G.工作液配制装置 |
生产过程中,把乙基蒽醌溶于有机溶剂配制成工作液,在一定的温度、压力和催化剂作用下进行氢化,再经氧化、萃取、净化等工艺得到双氧水。回答下列问题:
(1)蒽醌法制备双氧水理论上消耗的原料是_______,循环使用的|原料是______,配制工作液时采用有机溶剂而不采用水的原因是______。
(2)氢化釜A中反应的化学方程式为_______,进入氧化塔C的反应混合液中的主要溶质为_______。
(3)萃取塔D中的萃取剂是____,选择其作萃取剂的原因是______。
(4)工作液再生装置F中要除净残留的H2O2,原因是______。
(5)双氧水浓度可在酸性条件下用KMnO4溶液测定,该反应的离子方程式为_______。一种双氧水的质量分数为27.5%,(密度为1.10g·cm3),其浓度为______mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3样品中混有一定量的Na2SO4(设均不含结晶水),某实验小组设计如下方案测定样品中Na2CO3的质量分数。
(1)甲同学通过测定二氧化碳的质量来测定碳酸钠的质量分数,实验装置如图:
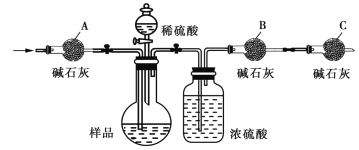
①主要实验步骤有:a.向装置中通入空气;b.称量干燥管B与装入碱石灰的总质量;c.打开分液漏斗活塞,使稀硫酸与样品充分反应。合理的步骤是_____(可重复)。
②按气体从左向右的流向,干燥管A的作用是____,干燥管C的作用是______。
(2)乙同学利用图ⅰ、ⅱ、ⅲ三个仪器组装一套装置完成Na2CO3质量分数的测定,其中样品已称量完毕,ⅲ中装有CO2难溶于其中的液体。

①ⅱ中盛装的是____(填代号)。
A.浓硫酸 B.饱和NaHCO3溶液 C.10mol·L1盐酸 D.2mol·L1硫酸
②用橡胶管连接对应接口的方式是:A接___,B接__,C接___(填各接口的编号)。
③在测量气体体积时,组合仪器与ⅳ装置相比更为准确,主要原因是____。组合仪器相对于ⅳ装置的另一个优点是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式与所述事实相符的是( )
A.向AlCl3溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B.向氯化铁溶液中滴加KSCN溶液显红色:Fe3++3SCN-![]() Fe(SCN)3
Fe(SCN)3
C.将nmolCl2通入含有nmolFeBr2的溶液中:2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应不正确的是( )
A.将少量铜屑放入浓硝酸中:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.将乙烷与溴蒸气混合置于光亮处生成一溴代物:CH3CH3+Br2![]() CH3CH2Br+HBr
CH3CH2Br+HBr
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列粒子:
①CH4 ②CH2 ===CH2 ③CH≡CH ④NH3 ⑤NH4 + ⑥BF3 ⑦H2O
填写下列空白(填序号):
(1)呈正四面体的是_____。
(2)中心原子轨道为 sp3 杂化的是_____,为 sp2 杂化的是_____,为 sp 杂化的是_____。
(3)所有原子共平面的是_____,共线的是_____。
(4)粒子存在配位键的是_____。
(5)含有极性键的极性分子的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
实施垃圾分类,节约使用资源是社会文明水平的重要体现。厨余垃圾作为一种兼具资源和环境污染双重性的固体废弃物占比超过50%~60%,是我国垃圾最主要的构成部分。2020年5月1日新修订的《北京市垃圾分类管理条例》实施以来,家庭厨余垃圾分出量明显增加。目前,北京市具备厨余垃圾处理能力的生化设施共23座,可满足全市处理需求。厨余垃圾经过除杂、除沙、提油后可“变身”为沼气、工业粗油脂、生物有机肥以及废水等。其中沼气可在厂内协同利用;工业粗油脂销售到有资质的生物柴油厂家可从根本上杜绝“地沟油”回流到餐桌;生物有机肥含有氮磷钾等元素,可用于园林绿化及农业生产;废水则通过无害化处理后回用于厂区,实现废水零排放。经过处理的厨余垃圾,有20%会成为不可利用的残渣,这些残渣将作为其它垃圾用于焚烧发电。

请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)厨余垃圾处理应在避免污染环境的同时提升资源利用效率。______
(2)厨余垃圾“变身”为沼气属于化学变化。_____
(3)工业粗油脂主要成分属于有机物。_____
(4)经过处理的厨余垃圾残渣,在焚烧发电过程中存在化学能、热能、电能间的转化。_____
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com