
【题目】下列文字表述与反应方程式对应不正确的是( )
A.将少量铜屑放入浓硝酸中:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.将乙烷与溴蒸气混合置于光亮处生成一溴代物:CH3CH3+Br2![]() CH3CH2Br+HBr
CH3CH2Br+HBr
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
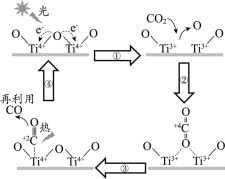
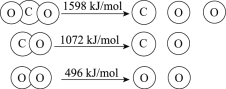
下列说法正确的是
A.过程①中钛氧键断裂会释放能量
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以降低反应的焓变,从而提高化学反应速率
D.CO2分解反应的热化学方程式为2CO2(g) =2CO(g) + O2(g) ΔH= + 30 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2017·天津卷)常压下羰基化法精炼镍的原理为:Ni(s)+4CO(g)![]() Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
Ni(CO)4(g)。230℃时,该反应的平衡常数K=2×105。已知:Ni(CO)4的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与CO反应转化成气态Ni(CO)4;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A. 增加c(CO),平衡向正向移动,反应的平衡常数增大
B. 第二阶段,Ni(CO)4分解率较低
C. 第一阶段,在30℃和50℃两者之间选择反应温度,选50℃
D. 该反应达到平衡时,v生成[Ni(CO)4]=4v生成(CO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和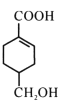 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。
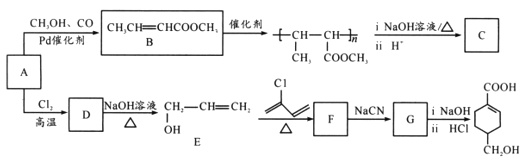
已知: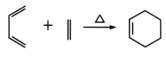 ,
,![]() RCOOH
RCOOH
(1) 发生缩聚形成的高聚物的结构简式为____;D→E的反应类型为____。
发生缩聚形成的高聚物的结构简式为____;D→E的反应类型为____。
(2)E→F的化学方程式为____。
(3)B的同分异构体中,与B具有相同官能团且能发生银镜反应,其中核磁共振氢谱上显示3组峰,且峰面积之比为6:1:1的是____(写出结构简式)。
(4)等物质的量的 分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为____;检验
分别与足量NaOH、NaHCO3反应, 消耗NaOH、NaHCO3的物质的量之比为____;检验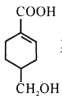 的碳碳双键的方法是____(写出对应试剂及现象)。
的碳碳双键的方法是____(写出对应试剂及现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的一组是( )
A. 甘油和乙醇互为同系物
B. CH2=CHCH2CH3 和 CH3CH=CHCH3 互为同分异构体
C.  是同一种物质
是同一种物质
D. O2 和 O3 互为同素异形体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃与氢气混合在常温常压时不反应,高温时反应很慢,但在适当的催化剂存在时可与氢气反应生成烷烃,一般认为加氢反应是在催化剂表面上进行。反应过程的示意图如图:

下列说法正确的是( )
A.乙烯和H2生成乙烷反应的△H>0
B.有催化剂时的活化能E2比无催化剂时的活化能E1低,不能减小反应的△H
C.催化加氢过程中金属氢化物的一个氢原子和双键碳原子先结合,得到中间体
D.催化加氢过程中催化剂将较难发生的反应分成了多个容易发生的反应,可提高反应物的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应H2(g)+I2(g)![]() 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂nmolH—H键的同时形成2nmolH—I键
②单位时间内生成nmolI2的同时生成2nmolHI
③2v正(H2)=v逆(HI)
④HI分子数不再改变
⑤混合气体颜色不再改变
⑥混合气体压强不再改变
A.②④⑤⑥B.②③④⑤C.①③④⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 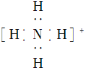 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学设计实验,探究中和反应的发生。
(实验过程)
编号 | 实验操作 |
实验I | 向滴有酚酞的氢氧化钠溶液中滴加稀盐酸,观察现象
|
实验II | 按如图进行实验,对比①、②中的实验现象
|
(分析与解释)
(1)中和反应的实质是______(用离子方程式表示)。
(2)实验I中,中和反应发生的现象是______。
(3)实验II中,能判断中和反应发生的依据是______。
a.反应结束消耗镁条的量②>①
b.镁条表面产生气泡的速率①>②
(4)实验II中,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com