
【题目】下列说法中正确的是
A. NO2、BF3、NCl3分子中没有一个分子中原子的最外层电子都满足了8电子稳定结构
B. P4和CH4都是正四面体形分子且键角都为109°28′
C. NH4+的电子式为 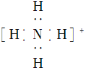 ,离子呈平面正方形结构
,离子呈平面正方形结构
D. NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强
【答案】D
【解析】
A.在ABn型化合物中,中心元素A的族序数+成键数=8时,满足分子中所有原子都满足最外层8电子结构,含H元素的化合物一定不满足;
B.白磷和甲烷分子都是正四面体结构,但甲烷分子中氢原子位于顶点上,碳原子位于体心上;
C.铵根离子和甲烷分子结构相似,根据甲烷分子结构确定铵根离子结构;
D.分子中,孤电子对对成键电子对的排斥力较大。
A. NCl3分子原子的最外层电子都满足了8电子稳定结构,故A错误;
B. 白磷的键角是60°,故B错误;
C. NH4+呈正四面体型结构,故C错误;
D.分子中,孤电子对对成键电子对的排斥力大于成键电子对对成键电子对的排斥力,所以NH3分子中有一对未成键的孤电子对,它对成键电子的排斥作用较强,故D正确;
答案选D。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】减少氮的氧化物和碳的氧化物在大气中的排放是环境保护的重要内容之一。合理应用和处理碳、氮及其化合物,在生产生活中有重要意义。
(1)对温室气体CO2的研究一直是科技界关注的重点。在催化剂存在下用H2还原CO2是解决温室效应的重要手段之一。
已知:①H2和CH4的燃烧热分别为285.5kJ/mol和890.0kJ/mol。
②H2O(1)=H2O(g) ΔH=+44kJ/mol
试写出H2还原CO2生成CH4和H2O(g)的热化学方程式__。
(2)CO2在CuZnO催化下,可同时发生如下的反应I、II,可作为解决温室效应及能源短缺的重要手段。
I.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
CH3OH(g)+H2O(g) ΔH1=-57.8kJ/mol
II.CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2=+41.2kJ/mol
CO(g)+H2O(g) ΔH2=+41.2kJ/mol
在CuZnO存在的条件下,保持温度T不变,在一刚性密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量如下表:
CO2 | H2 | CH3OH | CO | H2O(g) | 总压/kPa | |
起始/mol | 5.0 | 7.0 | 0 | 0 | 0 | p0 |
平衡/mol | n1 | n2 | p |
若反应I、II均达平衡时,p0=1.2p,则表中n1=__,此时n2=3.则反应I的平衡常数Kp=__(无需带单位,用含总压p的式子表示。已知:气体各组分的分压p(B),等于总压乘以其体积分数)。
(3)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸,CO2(g)+CH4(g)![]() CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。
CH3COOH(g)。在不同温度下催化剂的催化效率与乙酸的生成速率如图所示。250~300℃时,乙酸的生成速率降低的主要原因是__;300~400℃时,乙酸的生成速率升高的主要原因是__。

(4)用活性炭还原法可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应:C(s)+2NO(g)![]() N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
N2(g)+CO2(g) ΔH>0在T℃时,反应进行到不同时间测得各物质的量浓度如下:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
c(NO)/molL1 | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
c(N2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
c(CO2)/molL1 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
30min后,只改变某一条件,根据上表的数据判断改变的条件可能是__填字母)。
A.通入一定量的CO2
B.加入合适的催化剂
C.适当缩小容器的体积
D.通入一定量的NO
E.加入一定量的活性炭
F.适当升高温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应不正确的是( )
A.将少量铜屑放入浓硝酸中:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.将乙烷与溴蒸气混合置于光亮处生成一溴代物:CH3CH3+Br2![]() CH3CH2Br+HBr
CH3CH2Br+HBr
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列粒子:
①CH4 ②CH2 ===CH2 ③CH≡CH ④NH3 ⑤NH4 + ⑥BF3 ⑦H2O
填写下列空白(填序号):
(1)呈正四面体的是_____。
(2)中心原子轨道为 sp3 杂化的是_____,为 sp2 杂化的是_____,为 sp 杂化的是_____。
(3)所有原子共平面的是_____,共线的是_____。
(4)粒子存在配位键的是_____。
(5)含有极性键的极性分子的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活关系密切。下列有关说法错误的是( )
A.港珠澳大桥使用的超高分子量聚乙烯纤维属于有机高分子化合物
B.质谱法是测定有机物相对分子质量及确定化学式的分析方法之一
C.“玉兔二号”月球车使用的帆板太阳能电池的材料是![]()
D.宋·王希孟《千里江山图》卷中绿色颜料“铜绿”的主要成分是碱式碳酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】判断含氧酸酸性强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示:
含氧酸酸性强弱与非羟基氧原子数的关系
次氯酸 | 磷酸 | 硫酸 | 高氯酸 | |
含氧酸 | Cl—OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
(1)已知,亚磷酸是中强酸,亚砷酸是弱酸且有一定的弱碱性,则H3PO3和H3AsO3与过量的NaOH溶液反应的化学方程式分别是①_____________________________,②__________________________________。
(2)在H3PO3和H3AsO3中分别加入浓盐酸,分析反应情况______________,写出化学方程式:____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是( )
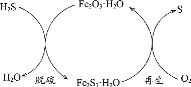
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
实施垃圾分类,节约使用资源是社会文明水平的重要体现。厨余垃圾作为一种兼具资源和环境污染双重性的固体废弃物占比超过50%~60%,是我国垃圾最主要的构成部分。2020年5月1日新修订的《北京市垃圾分类管理条例》实施以来,家庭厨余垃圾分出量明显增加。目前,北京市具备厨余垃圾处理能力的生化设施共23座,可满足全市处理需求。厨余垃圾经过除杂、除沙、提油后可“变身”为沼气、工业粗油脂、生物有机肥以及废水等。其中沼气可在厂内协同利用;工业粗油脂销售到有资质的生物柴油厂家可从根本上杜绝“地沟油”回流到餐桌;生物有机肥含有氮磷钾等元素,可用于园林绿化及农业生产;废水则通过无害化处理后回用于厂区,实现废水零排放。经过处理的厨余垃圾,有20%会成为不可利用的残渣,这些残渣将作为其它垃圾用于焚烧发电。

请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)厨余垃圾处理应在避免污染环境的同时提升资源利用效率。______
(2)厨余垃圾“变身”为沼气属于化学变化。_____
(3)工业粗油脂主要成分属于有机物。_____
(4)经过处理的厨余垃圾残渣,在焚烧发电过程中存在化学能、热能、电能间的转化。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为________________________。
②Fe的一种晶胞结构如图所示,测得晶胞边长为 a pm,则Fe原子半径为__________。
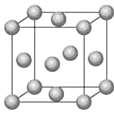
③已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为________。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体是_________;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是_____(填“A”或“B”),理由是___________。
A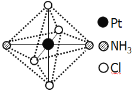 B
B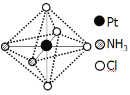
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。
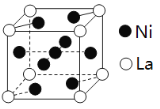
①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为____________ (不必计算结果) 。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为____________。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]() 表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为![]() 。 下列微粒中存在“离域Π键”的是__________。
。 下列微粒中存在“离域Π键”的是__________。
a.O3 b.SO42- c.H2S d.NO3-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com