
【题目】反应H2(g)+I2(g)![]() 2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
2HI(g)在体积固定的密闭容器中进行,达到平衡状态的标志是( )
①单位时间内断裂nmolH—H键的同时形成2nmolH—I键
②单位时间内生成nmolI2的同时生成2nmolHI
③2v正(H2)=v逆(HI)
④HI分子数不再改变
⑤混合气体颜色不再改变
⑥混合气体压强不再改变
A.②④⑤⑥B.②③④⑤C.①③④⑤D.全部
【答案】B
【解析】
①H—H键断裂和H—I键生成均为正反应,只要反应进行,单位时间内断裂nmolH—H键的同时就会形成2nmolH—I键,故①不能说明反应达到平衡;
②单位时间内生成nmolI2的同时生成2nmolHI,说明I2的消耗量与生成量相同,即正逆反应相等,故②能说明反应达到平衡;
③反应进行时2v正(H2)=v正(HI),所以当2v正(H2)=v逆(HI)时也就是v正(HI)=v逆(HI),故③能说明反应达到平衡;
④HI分子数不再改变,说明正逆反应速率相等,故④能说明反应达到平衡;
⑤碘蒸气有颜色,混合气体颜色不再改变说明碘蒸气的浓度不再改变,故⑤能说明反应达到平衡;
⑥该反应前后气体系数之和相等,反应过程中气体的总物质的量不变,容器恒容,所以压强一直不变,故⑥不能说明反应达到平衡;
综上所述符合题意的有②③④⑤,故答案为B。


科目:高中化学 来源: 题型:
【题目】利用生活中或实验中常见的物品,根据氧化还原反应知识和电化学知识,自己动手设计一个原电池。请填写下列空白:
(1)实验原理:Fe+2H+=Fe2++H2↑。
(2)实验原理:电极(______、______)、________、________、稀硫酸、耳机(或者电流计)。(请在空格中填写所缺的实验用品)
(3)实验装置(如图)。
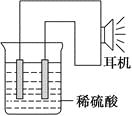
(4)原电池设计及注意的问题:
①按如图所示连接好实验仪器,注意观察(耳朵听)耳机是否有声音发出,如果没有,可将原电池的两个电极中的一极接触耳机插头上的一极(注意:接触的同时耳机的另一极是连接在原电池的另一个电极上的),这时可以听见耳机发出“嚓嚓嚓……”的声音。其原因是:在原电池中,由化学能转化为________,在耳机中又由________转化为声音这种能量。
②如果将装置中的耳机改为电流计,则铁钉应该接电流计的________极,电极反应是_____________________________,发生了________反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Na2CO3样品中混有一定量的Na2SO4(设均不含结晶水),某实验小组设计如下方案测定样品中Na2CO3的质量分数。
(1)甲同学通过测定二氧化碳的质量来测定碳酸钠的质量分数,实验装置如图:
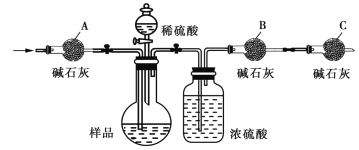
①主要实验步骤有:a.向装置中通入空气;b.称量干燥管B与装入碱石灰的总质量;c.打开分液漏斗活塞,使稀硫酸与样品充分反应。合理的步骤是_____(可重复)。
②按气体从左向右的流向,干燥管A的作用是____,干燥管C的作用是______。
(2)乙同学利用图ⅰ、ⅱ、ⅲ三个仪器组装一套装置完成Na2CO3质量分数的测定,其中样品已称量完毕,ⅲ中装有CO2难溶于其中的液体。

①ⅱ中盛装的是____(填代号)。
A.浓硫酸 B.饱和NaHCO3溶液 C.10mol·L1盐酸 D.2mol·L1硫酸
②用橡胶管连接对应接口的方式是:A接___,B接__,C接___(填各接口的编号)。
③在测量气体体积时,组合仪器与ⅳ装置相比更为准确,主要原因是____。组合仪器相对于ⅳ装置的另一个优点是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应不正确的是( )
A.将少量铜屑放入浓硝酸中:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.将乙烷与溴蒸气混合置于光亮处生成一溴代物:CH3CH3+Br2![]() CH3CH2Br+HBr
CH3CH2Br+HBr
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】应对雾霾污染、改善空气质量需要从多方面入手,如开发利用清洁能源。甲醇是一种可再生的清洁能源,具有广阔的开发和应用前景。回答下列问题:
(1)CO2与H2合成甲醇:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
CH3OH(g)+H2O(g)。但是找到合适的催化剂是制约该方法的瓶颈。目前主要使用贵金属催化剂,但是贵金属储量稀少,成本高昂,难以大规模应用,且使用中存在环境污染的风险。最近采用真空封管法制备磷化硼纳米颗粒,在发展非金属催化剂实现CO2电催化还原制备甲醇方向取得重要进展,该反应历程如图所示。
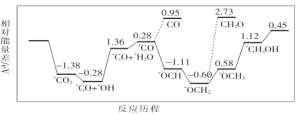
容易得到的副产物有CO和CH2O,其中相对较多的副产物为__;上述合成甲醇的反应速率较慢,要使反应速率加快,主要降低下列变化中__(填字母)的能量变化。
A.*CO+*OH→*CO+*H2O
B.*CO→*OCH
C.*OCH2→*OCH3
D.*OCH3→*CH3OH
(2)恒压(容器的容积可变)下,0.2molCO2与0.6molH2在催化剂作用下发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
CH3OH(g)+H2O(g) △H,CO2的平衡转化率与温度、压强的关系如图所示。
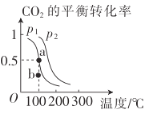
压强p1__(填“<”或“>”)p2。
②在p1、100℃条件下,b点时v正__(填“<"或“>”)v逆。
③已知:反应速率v=v正-v逆=k正![]() ,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的
,k正、k逆分别为正、逆反应速率常数,x为物质的量分数,若b点对应的坐标参数为(100,0.4),计算b处的![]() =__(保留3位有效数字)。
=__(保留3位有效数字)。
(3)焦炭与水蒸气在恒容密闭容器中反应制合成气的主要反应(Ⅰ)、(Ⅱ)的lgKP(KP为以分压表示的平衡常数)与T的关系如图所示。
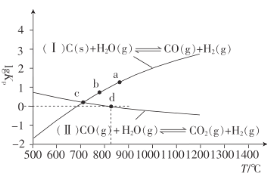
反应(Ⅱ)的△H__(填“大于”“等于”或“小于”)0。
②c点时,反应C(s)+CO2(g)![]() 2CO(g)的KP=__(填数值)。
2CO(g)的KP=__(填数值)。
③在恒容密闭容器中充入0.5molCO、2molH2O(g)只发生反应(Ⅱ),图中d点处达到平衡时,CO的转化率为__;达到平衡时,向容器中再充入0.5molCO、2molH2O(g),重新达到平衡时,CO的平衡转化率__(填“增大”“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列粒子:
①CH4 ②CH2 ===CH2 ③CH≡CH ④NH3 ⑤NH4 + ⑥BF3 ⑦H2O
填写下列空白(填序号):
(1)呈正四面体的是_____。
(2)中心原子轨道为 sp3 杂化的是_____,为 sp2 杂化的是_____,为 sp 杂化的是_____。
(3)所有原子共平面的是_____,共线的是_____。
(4)粒子存在配位键的是_____。
(5)含有极性键的极性分子的是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产生活关系密切。下列有关说法错误的是( )
A.港珠澳大桥使用的超高分子量聚乙烯纤维属于有机高分子化合物
B.质谱法是测定有机物相对分子质量及确定化学式的分析方法之一
C.“玉兔二号”月球车使用的帆板太阳能电池的材料是![]()
D.宋·王希孟《千里江山图》卷中绿色颜料“铜绿”的主要成分是碱式碳酸铜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是( )
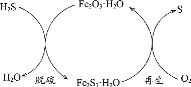
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.氯化铝溶液与过量的氢氧化钠溶液反应:Al3++3OH-=Al(OH)3↓
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与稀盐酸反应:2H++CO32-=CO2↑+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com