
【题目】某小组同学设计实验,探究中和反应的发生。
(实验过程)
编号 | 实验操作 |
实验I | 向滴有酚酞的氢氧化钠溶液中滴加稀盐酸,观察现象
|
实验II | 按如图进行实验,对比①、②中的实验现象
|
(分析与解释)
(1)中和反应的实质是______(用离子方程式表示)。
(2)实验I中,中和反应发生的现象是______。
(3)实验II中,能判断中和反应发生的依据是______。
a.反应结束消耗镁条的量②>①
b.镁条表面产生气泡的速率①>②
(4)实验II中,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是______。
【答案】H++OH-=H2O 溶液由红色逐渐变为无色 b 相同温度和压强下,用气球收集①、②中完全反应时产生的气体,①中收集气体的气球比②中收集气体的气球体积大。
【解析】
实验I:由于酚酞遇碱变红,向氢氧化钠溶液中滴加酚酞,溶液变红,再向溶液中滴加盐酸,发生酸碱中和反应,溶液中氢氧根离子被消耗,随着盐酸的滴加,氢氧根离子逐渐减少至完全被消耗,溶液由红色逐渐变为无色;
实验II:操作①、②中盐酸的物质的量相同,直接与打磨过的相同质量的镁条反应,发生的离子反应都为:Mg+2H+= Mg2++H2↑,完全反应后,①、②中消耗镁条的质量相同;若操作①先加水稀释,氢离子的总的物质的量不变,操作②先加氢氧化钠溶液发生反应生成水,氢离子的总的物质的量减小,①、②中都进行操作i后,溶液体积都为6mL,则①中的氢离子浓度大于②中氢离子的浓度,都与打磨过的相同质量的镁条反应,完全反应后,①中消耗的镁条的质量比②中消耗的镁条质量更多,①中的氢离子浓度大,与镁条反应时的速率①>②,综上分析②中加入氢氧化钠后氢离子被消耗,证明加入氢氧化钠后与盐酸发生了中和反应,据此分析解答。
(1)中和反应的实质是H++OH-=H2O;
(2)实验I中,中和反应发生的现象是溶液由红色逐渐变为无色;
(3)根据分析,实验II中,反应结束消耗镁条的量①>②,镁条表面产生气泡的速率①>②,则能判断中和反应发生的依据是b;
(4)实验II中,由于氢离子的物质的量①>②,镁条完全反应时,相同条件下,产生氢气的体积①>②,如果提供温度计、气球(收集气体)等辅助仪器,还能获取证明中和反应发生的实验证据是相同温度和压强下,用气球收集①、②中完全反应时产生的气体,①中收集气体的气球比②中收集气体的气球体积大。


科目:高中化学 来源: 题型:
【题目】下列文字表述与反应方程式对应不正确的是( )
A.将少量铜屑放入浓硝酸中:Cu+4H++2NO![]() =Cu2++2NO2↑+2H2O
=Cu2++2NO2↑+2H2O
B.用醋酸除去水垢:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
C.将乙烷与溴蒸气混合置于光亮处生成一溴代物:CH3CH3+Br2![]() CH3CH2Br+HBr
CH3CH2Br+HBr
D.氯气和水反应:Cl2+H2O=2H++Cl-+ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S是一种大气污染物。干法氧化铁脱硫是目前除去煤气中H2S的常用方法,其原理如图所示。下列说法不正确的是( )
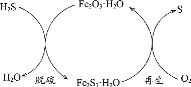
A.单质硫为淡黄色固体
B.脱硫反应为3H2S+Fe2O3·H2O=Fe2S3·H2O+3H2O
C.再生过程中,硫元素被还原
D.脱硫过程中,增大反应物的接触面积可提高脱硫效率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读短文,回答问题。
实施垃圾分类,节约使用资源是社会文明水平的重要体现。厨余垃圾作为一种兼具资源和环境污染双重性的固体废弃物占比超过50%~60%,是我国垃圾最主要的构成部分。2020年5月1日新修订的《北京市垃圾分类管理条例》实施以来,家庭厨余垃圾分出量明显增加。目前,北京市具备厨余垃圾处理能力的生化设施共23座,可满足全市处理需求。厨余垃圾经过除杂、除沙、提油后可“变身”为沼气、工业粗油脂、生物有机肥以及废水等。其中沼气可在厂内协同利用;工业粗油脂销售到有资质的生物柴油厂家可从根本上杜绝“地沟油”回流到餐桌;生物有机肥含有氮磷钾等元素,可用于园林绿化及农业生产;废水则通过无害化处理后回用于厂区,实现废水零排放。经过处理的厨余垃圾,有20%会成为不可利用的残渣,这些残渣将作为其它垃圾用于焚烧发电。

请依据以上短文,判断下列说法是否正确(填“对”或“错”)。
(1)厨余垃圾处理应在避免污染环境的同时提升资源利用效率。______
(2)厨余垃圾“变身”为沼气属于化学变化。_____
(3)工业粗油脂主要成分属于有机物。_____
(4)经过处理的厨余垃圾残渣,在焚烧发电过程中存在化学能、热能、电能间的转化。_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表是科学界最重要的成就之一。作为一种独特的工具,它使科学家能够预测地球上和宇宙中物质的外观、性质及结构等。
(1)通常制造的农药含元素F、P、S、Cl。四种元素的电负性从大到小的顺序为_______;第一电离能从大到小的顺序为_________。
(2)科学家曾利用元素周期表寻找F、Cl的含碳化合物作为制冷剂。已知CCl4的沸点为76.8℃,CF4的沸点为-128℃,若要求制冷剂沸点介于两者之间,则含一个碳原子的该制冷剂可以是__________(写出其中一种的化学式)。
(3)1963年以来科学家借助射电望远镜,在星际空间已发现NH3、HC≡C-C≡N等近两百种星际分子。与NH3互为等电子体的阳离子为____;HC≡C-C≡N分子中![]() 键与
键与![]() 键的数目比n(
键的数目比n(![]() )∶n(
)∶n(![]() )=__________。
)=__________。
(4)过渡元素(包括稀土元素)中可寻找各种优良催化剂。Sc的一种氢化物的晶胞结构如图所示,该氢化物的化学式为_________。
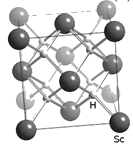
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:
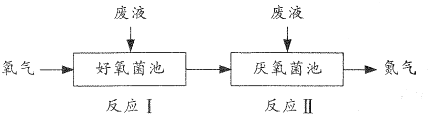
反应I:NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) △H1=akJ·mol-1
反应Ⅱ:5NH4+(aq)+3NO3-(aq)=4N2(g)+9H2O(l)+2H+(aq) △H2=bkJ·mol-1
下列说法正确的是
A.两池发生的反应中,氮元素只被氧化
B.两池中投放的废液体积相等时,NH4+能完全转化为N2
C.常温常压下,反应Ⅱ中生成22.4 L N2转移的电子数为3.75NA
D.4NH4+(aq)+3O2(g)=2N2(g)+6H2O(l)+4H+(aq) △H=![]() (3a+b) kJ·mol-1
(3a+b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是( )
A.铁与氯化铁溶液反应:Fe+Fe3+=2Fe2+
B.氯化铝溶液与过量的氢氧化钠溶液反应:Al3++3OH-=Al(OH)3↓
C.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
D.碳酸氢钠溶液与稀盐酸反应:2H++CO32-=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属元素Fe、Ni、Pt均为周期表中同族元素,该族元素的化合物在研究和生产中有许多重要用途。
(1)Fe是常见的金属,生活中用途广泛。请回答下列问题:
①Fe在元素周期表中的位置为________________________。
②Fe的一种晶胞结构如图所示,测得晶胞边长为 a pm,则Fe原子半径为__________。
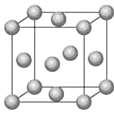
③已知:FeO晶体晶胞结构为NaCl型,与O2-距离最近且等距离的亚铁离子围成的空间构型为________。
(2)铂可与不同的配体形成多种配合物,分子式为[Pt(NH3)2Cl4]的配合物的配体是_________;该配合物有两种不同的颜色,其中橙黄色比较不稳定,在水中的溶解度大;呈亮黄色的物质在水中的溶解度小,如下图所示的结构示意图中呈亮黄色的是_____(填“A”或“B”),理由是___________。
A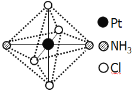 B
B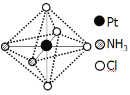
(3)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图。
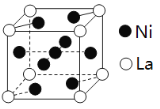
①测知镧镍合金晶胞体积为9.0×10-23cm3,则镧镍合金的晶体密度为____________ (不必计算结果) 。
②储氢原理为:镧镍合金吸附H2,H2解离为原子,H原子储存在其中形成化合物。若储氢后,氢原子占据晶胞中上下底面的棱和面心,则形成的储氢化合物的化学式为____________。
(4)已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域π键”(或大π键)。大π键可用![]() 表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为
表示,其中m、n分别代表参与形成大π键的电子数和原子个数,如苯分子中大π键表示为![]() 。 下列微粒中存在“离域Π键”的是__________。
。 下列微粒中存在“离域Π键”的是__________。
a.O3 b.SO42- c.H2S d.NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实对应的离子方程式正确的是
A. 用石墨电极电解饱和食盐水:Cl- + 2H2O ![]() Cl2↑+ H2↑+ OH-
Cl2↑+ H2↑+ OH-
B. 用醋酸除去水壶中的水垢:CaCO3 + 2H+ === Ca2+ + CO2↑+ H2O
C. (NH4)2Fe(SO4)2溶液中滴加过量Ba(OH)2溶液:Fe2+ + 2OH- + Ba2+ + SO42— === Fe(OH)2↓ + BaSO4↓
D. 用明矾做净水剂:Al3+ + 3H2O ![]() Al(OH)3 + 3H+
Al(OH)3 + 3H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com