
【题目】某小组为探究 AgNO3溶液和不同类型盐溶液反应的多样性,设计如图实验:
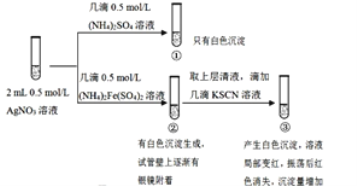
已知:AgSCN为白色难溶物。
下列说法中,不正确的是
A.向①的试管中滴加 0.5 mol/L KI溶液,有黄色沉淀生成证明存在Ag2SO4(s)+2I![]() 2AgI(s)+SO42
2AgI(s)+SO42
B.①中的白色沉淀是Ag2SO4
C.②中发生了氧化还原反应
D.对于③中红色褪去的原因可能与平衡移动原理有关
【答案】A
【解析】
A.①中硝酸银是过量的,再加入KI和硝酸银反应生成沉淀,不是沉淀转化,故A错误;
B.硝酸银溶液中滴入硫酸铵,生成白色沉淀为硫酸银,化学式为Ag2SO4,故B正确;
C.②中硝酸银溶液中滴入硫酸亚铁铵,有白色沉淀生成是生成的硫酸银,试管壁有银析出,可能发生银离子氧化亚铁离子为铁离子,银离子被还原为银单质,反应的离子方程式为Ag++Fe2+=Ag+Fe3+,②发生了氧化还原反应,故C正确;
D.红色褪去的原因与平衡移动原理有关,局部溶液发生反应Fe3++3SCN-![]() Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色,故D正确;
Fe(SCN)3,当振荡试管时,溶液中过量银银离子与硫氰根反应生成白色沉淀AgSCN,降低了硫氰根离子的浓度,上述平衡逆向进行溶液褪色,故D正确;
故答案为A。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向0.10mol·L-1的H2C2O4(二元弱酸)溶液中滴加NaOH溶液,溶液中部分微粒的物质的量浓度随pH的变化曲线如图所示。下列说法不正确的是

A. 25℃时H2C2O4的一级电离常数为Ka1=104.3
B. pH=2.7的溶液中:c(H2C2O4)=c(C2O42-)
C. pH=7的溶液中:c(Na+)>2c(C2O42-)
D. 滴加NaOH溶液的过程中始终存在:c(OH-)+2c(C2O42-)+c(HC2O4-)=c(Na+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向50 mL溶有0.1molCl2的氯水中滴加2mol/L的NaOH溶液,得到溶液pH随所加NaOH溶液体积的变化图像如下图所示。下列说法正确的是
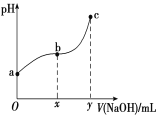
A. 若a点pH=4,且c(Cl-)=m·c(ClO-),则Ka(HClO)=![]()
B. 若x=100,b点对应溶液中:c(OH-)>c(H+),可用pH试纸测定其pH
C. b~c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
D. 若y=200,c点对应溶液中:c(OH-)-c(H+)=2c(Cl-)+c(HClO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1molCl-、ClOx-(x=1、2、3、4)的能量(kJ)相对大小如图所示。下列说法正确的是( )
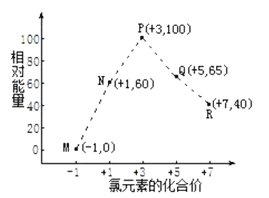
A.P点对应的微粒最稳定
B.R点微粒氧化性最强
C.由N点到M点的焓变为60kJ·mol-1
D.P点微粒发生歧化反应转化为N点和Q点微粒属于自发过程
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) ΔH<0,一段时间后达到平衡,反应过程中测定的数据如下表:
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
下列说法正确的是
A.其他条件不变,升高温度,此反应的平衡常数增大
B.反应前2min的平均速率ν(Z)=4.0×10-3mol·L-1·min-1
C.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
D.其他条件不变,再充入0.2mol Z,平衡时X的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再生利用.某校研究小组尝试回收废旧正极材料中的钴。
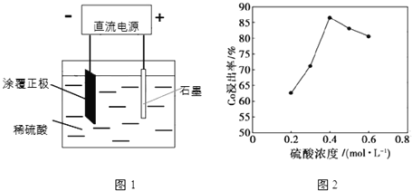
(1)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O,阳极的电极反应式为______。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4molL-1时,钴的浸出率下降,其原因可能为______。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。

①写出“酸浸”过程中正极粉发生反应的化学方程式______。该步骤一般在80℃以下进行,温度不能太高的原因是______。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是______(填字母序号)。
a.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
b.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(HC2O42-)
c.c(NH4+)+c(NH3H2O)=2[c(HC2O42-)+c(HC2O4-)+c(H2C2O4)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2A(g)+3B(g)![]() 4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
4C(g)+D(g), 已知起始浓度c(A)=4 mol·L-1,c(B)=3 mol·L-1,C、D浓度均等于0,反应开始2 秒后达到平衡状态,此时D 的平衡浓度为0.5 mol·L-1,则下列说法不正确的是( )
A. 反应速率v(C)= 1mol/(L·s) B. C的平衡浓度为4mol /L
C. A的转化率为25% D. B的平衡浓度为1.5mol /L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应N2(g)+3H2(g)![]() 2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2NH3(g),若N2、H2、NH3起始浓度分别为c1、c2、c3(均不为零),到达平衡时,N2、H2、NH3的浓度分别为0.1mol·L-1、0.3 mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A.c1:c2=3:1
B.平衡时,H2和NH3的生成速率之比为2:3
C.N2和H2的转化率不相等
D.c1的取值范围为0mol·L-1<c1<0.14mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】滴定实验是化学学科中重要的定量实验,氧化还原滴定实验与酸碱中和滴定类似。测血钙的含量时,进行如下实验:
①可将4mL血液用蒸馏水稀释后,向其中加入足量草酸铵(NH4)2C2O4晶体,反应生成CaC2O4沉淀,将沉淀用稀硫酸处理得H2C2O4溶液。
②将①得到的H2C2O4溶液,再用酸性KMnO4溶液滴定,氧化产物为CO2,还原产物为Mn2+。
③终点时用去20mL l.0×l0-4mol/L的KMnO4溶液。
(1)写出KMnO4溶液滴定H2C2O4溶液的离子方程式______________________________________;滴定时,KMnO4溶液应装在______(“酸”或“碱”)式滴定管中,滴定终点时滴定现象是_________________________。
(2)下列操作会导致测定结果偏低的是_________。
A.滴定管在装液前未用标准KMnO4溶液润洗
B.滴定过程中,锥形瓶摇荡得太剧烈,锥形瓶内有液滴溅出
C.滴定管尖嘴部分在滴定前没有气泡,滴定终点时发现气泡
D.达到滴定终点时,仰视读数
(3)计算:血液中含钙离子的浓度为_________mol/L。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com