
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A.同温度、同体积的H2和N2B.同体积、同密度的C2H4和CH4
C.同质量、不同密度的N2和COD.同压强、同体积的N2O和CO2
【答案】C
【解析】
A. 气体体积受温度、压强的影响,同温、同体积的H2和N2,因为压强未知,所以两种气体的物质的量不一定相同,所含分子数不一定相同,导致所含原子数不一定相同,故A错误;
B. 同体积同密度的C2H4和CH4,两种气体的质量相同,由N=n×NA=![]() ×NA,设C2H4和CH4均为ag,计算可知同体积、同密度的C2H4所含原子物质的量为:
×NA,设C2H4和CH4均为ag,计算可知同体积、同密度的C2H4所含原子物质的量为:![]() ,CH4所含原子物质的量为:
,CH4所含原子物质的量为:![]() ,故B错误;
,故B错误;
C. 两种气体的质量相同,摩尔质量相同,则所含分子数相同,且氮气和一氧化碳都是双原子分子,所以含有的原子数相同,故C正确;
D. 气体体积受温度、压强的影响,因为温度未知,所以同压、同体积的N2O和CO2,两种气体的物质的量不一定相等,所含分子数不一定相等,导致所含原子数不一定相等,故D错误;
故选C。


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是
2C(g)达到平衡状态标志的是
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A. ①⑥ B. ②④ C. ③⑧ D. ②⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸是一种酸,草酸晶体(H2C2O42H2O)易溶于水,熔点较低,加热会熔化、气化和分解。草酸(H2C2O4)与氢氧化钙的反应:H2C2O4+Ca(OH)2=CaC2O4↓(白色)+2H2O。
(1)草酸的水溶液的pH___7(填“>”、“=”、“<”)
(2)实验室可用加热草酸晶体分解的方法获得CO。
①先加热草酸晶体生成CO、CO2和H2O,其化学方程式是____;
②最后用图1装置收集CO,气体应从___端进入(选填“a”或“b”)。
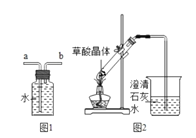
(3)实验图2中观察到澄清石灰水变浑浊,乙认为一定是由草酸晶体受热分解产生的CO2所导致,丙认为乙的结论不严密,理由是___。
按图3装置将草酸钙晶体(H2C2O4xH2O)样品高温加热,使其完全分解。

(4)B中观察到硫酸铜变蓝,说明反应生成了_____;
(5)C、G中澄清石灰水均变浑浊,说明反应还生成___和___气体。
(6)反应开始前通入氮气的目的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
①FeO投入稀H2SO4和稀HNO3中均得到浅绿色溶液
②向红砖粉末中加入盐酸,充分振荡反应后取上层清液于试管中,滴加KSCN溶液23滴,溶液呈红色,但不一定说明红砖中含有氧化铁
③Fe2O3![]() FeCl3(aq)
FeCl3(aq)![]() 无水FeCl3
无水FeCl3
④制备氢氧化亚铁时,向硫酸亚铁溶液中滴加氢氧化钠溶液,边加边搅拌,即可制得白色的氢氧化亚铁
⑤向一定量的Cu、Fe2O3的混合物中加入300 mL1.mol·L-1的盐酸,恰好使混合物完全溶解,所得溶液中不含有Fe3+。若用过量的CO在高温下还原相同质量的此混合物,固体减少的质量为2.4g
⑥磁性氧化铁溶于稀硝酸的离子方程式为3Fe2++4H++NO3-=== Fe3++NO↑+3H2O
⑦氢氧化铁与HI溶液反应的离子方程式为Fe(OH)3+H+=Fe3++3H2O
⑧Fe2O3不可与水反应得到Fe(OH)3,但能通过化合反应制取Fe(OH)3
⑨赤铁矿的主要成分是Fe3O4,Fe3O4为红棕色晶体
A. ①④⑦ B. ⑤⑧ C. ②③⑥ D. ⑤⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述不相符的是
A. 
微生物燃料电池,可将工业废水中的乙胺(CH3CH2NH2)转化成环境友好的物质(M、N均为铂电极),N电极的电极反应式为2CH3CH2NH2+8H2O-30e-== 4CO2↑+N2↑+30H+
B. 
反应xA(g)+yB(g) ![]() zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
zC(g)的ΔH>0,当n(A)/n(B)=2时,A、B的转化率之比为2:1
C. 
恒温恒容条件下,发生的可逆反应2NO2(g) ![]() N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中A点对应的状态为化学平衡状态
D. 
利用N2O4制备N2O5的装置(隔膜只允许H+通过,不允许H2O分子通过),其阳极的电极反应式为N2O4+2HNO3 —2e-== 2N2O5+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫是一种很活泼的元素,在适宜的条件下能形成2、+6、+4、+2、+1价的化合物。
Ⅰ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一,带有强烈的SO2气味,久置于空气中易被氧化,其溶于水生成的NaHSO3溶液呈酸性。某研究小组采用如图所示装置(实验前已除尽装置内的空气)制取Na2S2O5。

(1)装置Ⅰ中的浓硫酸____(能或不能)用稀硫酸代替,原因是______________________________________________。
(2)装置Ⅱ中有Na2S2O5晶体析出,要获得已析出的晶体,可采取的操作是__________。
(3)设计检验Na2S2O5晶体在空气中变质的实验方案:_______________。
Ⅱ.Na2S2O3溶液可以用于测定溶液中ClO2的含量,实验方案如下。
步骤1:准确量取ClO2溶液10.00 mL,稀释至100 mL。
步骤2:量取V1 mL稀释后的ClO2溶液于锥形瓶中,调节溶液的pH≤2,加入足量的KI晶体,摇匀,在暗处静置30分钟。(已知:ClO2+I+H+![]() I2+Cl+H2O 未配平)
I2+Cl+H2O 未配平)
步骤3:以淀粉溶液作指示剂,用c mol·L1 Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL。(已知:I2+2S2O32—=2I+ S4O62—)
(1)准确量取10.00 mL ClO2溶液的玻璃仪器是____________。
(2)确定滴定终点的现象为________________________________。
(3)根据上述步骤计算出原ClO2溶液的物质的量浓度为____mol·L1(用含字母的代数式表示)。
(4)下列操作会导致测定结果偏高的是_______________ (填字母)。
A.未用标准浓度的Na2S2O3溶液润洗滴定管
B.滴定前锥形瓶中有少量水
C.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
D.读数时,滴定前仰视,滴定后俯视
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤族元素在自然界中都以典型的盐类存在,包括氟、氯、溴、碘和砹五种元素,位于元素周期表的第ⅦA族,其中氯、溴和碘主要来之海水。卤素元素在生产实际中承担着重要角色。请回答下列问题:
(1)将经过验纯的氢气点燃,伸入盛有氯气的集气瓶中,在集气瓶口可观察到的现象是_________。
(2)欲检验Na2CO3、Na2SO4、NaCl的混合溶液中的Cl-,正确的操作方法是_____________。
(3)海水晒盐所获取的粗盐,经过提纯、精制之后,其水溶液进行电解,可以得到重要的化工原料。请写出该电解反应的离子方程式______。海带中提取碘时,将海带烘干、灼烧目的是_____、_____。
(4)将0.01 molCl2通入含0.03 molNaBr和0.03 molKI的混合液中,发生反应的离子方程式为_____;再将所得溶液分为两等份,其中一份蒸干、灼烧,最后得到的固体的成分一定有KCl,还有___;另一份再加入少量CCl4,振荡,则CCl4层的颜色是____,分离CCl4层和水层的操作名称是__,需要使用的玻璃仪器除烧杯外,还有_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电渗析法可将含硝酸钠的废水再生为硝酸和氢氧化钠,其装置如图所示。

下列叙述不正确的是
A. 膜a、膜c分别是阴离子交换膜、阳离子交换膜
B. 阳极室、阴极室的产品分别是氢氧化钠、硝酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 该装置工作时,电路中每转移0.2 mol 电子,两极共生成气体3.36L(标准状况)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,还可利用CO2据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。
(1)利用CO2和H2反应合成甲醇的原理为:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
上述反应常用CuO和ZnO的混合物作催化剂。相同的温度和时间段内,催化剂中CuO的质量分数对CO2的转化率和CH3OH的产率影响的实验数据如下表所示:
ω(CuO)/% | 10 | 20 | 30 | 4b | 50 | 60 | 70 | 80 | 90 |
CH3OH的产率 | 25% | 30% | 35% | 45% | 50% | 65% | 55% | 53% | 50% |
CO2的转化率 | 10% | 13% | 15% | 20% | 35% | 45% | 40% | 35% | 30% |
由表可知,CuO的质量分数为________催化效果最佳。
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)![]() CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)
CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是(______)

A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)①在1L的恒定密闭容器中按物质的量之比1︰2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化情况如图1所示,则压强P2________P1(填“>”、“<”或“=”);平衡由A点移至C点、D点移至B点,分别可采取的具体措施为________、________;在c点时,CO的转化率为________。
②甲和乙两个恒容密闭容器的体积相同,向甲中加入1molCO和2molH2,向乙中加入2molCO和4molH2,测得不同温度下CO的平衡转化率如图2所示,则L、M两点容器内压强:P(M)________2P(L);平衡常数:K(M)________K(L)。(填“>”、“<”或“=”)

(4)以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯![]() (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com