
【题目】在一定温度下,下列叙述不是可逆反应A(g)+3B(g)![]() 2C(g)达到平衡状态标志的是
2C(g)达到平衡状态标志的是
①C生成的速率与C分解的速率相等;②单位时间内生成a mol A,同时生成3a mol B;③A、B、C的浓度不再变化;④A、B、C的压强不再变化;⑤混合气体的总压强不再变化;⑥混合气体的物质的量不再变化;⑦单位时间内消耗a mol A,同时生成3a mol B;⑧A、B、C的分子数之比为1∶3∶2
A. ①⑥ B. ②④ C. ③⑧ D. ②⑧
【答案】D
【解析】
①C生成的速率与C分解的速率相等,即正反应速率与逆反应速率相等,故可以说明反应达到平衡;②单位时间内生成a mol A,同时生成3a mol B,只有逆反应速率,不能说明正反应速率和逆反应速率相等,故不能说明反应达到平衡;③A、B、C的浓度不再变化,浓度不在改变说明达到平衡,故可以选;④A、B、C的压强不再变化,说明A、B、C的浓度不再变化,可以说明反应达到平衡;⑤因为反应物和生成物中气体的总物质的量不同,所以混合气体的总压强不再变化,说明各物质的浓度不再改变,可以说明反应达到平衡;⑥反应前后气体的物质的量不同,故混合气体的物质的量不再变化时,能够说明反应达到平衡;⑦单位时间内消耗a mol A,同时生成3a mol B,说明正反应速率等于逆反应速率,故可以说明反应达到平衡;⑧A、B、C的分子数之比为1∶3∶2,不能说明各组分的浓度不再变化,故不可以说明反应达到平衡。
故选D。


科目:高中化学 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是

A. 质子透过阳离子交换膜由右向左移动
B. 电子流动方向为N→Y→X→M
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.糖类和油脂都是高分子化合物
B.蔗糖和麦芽糖互为同分异构体
C.葡萄糖和果糖互为同系物
D.纤维素可以被人体吸收,并释放能量供人体生命活动需要
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置中,a、b、c、d、e、f 均为惰性电极,电解质溶液均足量。接通电源后,d 极附近显红色。下外说法正确的是

A. 电源B 端是正极
B. f 极附近红褐色变深,说明氢氧化铁胶粒带正电
C. 欲用丁装置给铜镀银,N 应为Ag,电解质溶液为AgNO3溶液
D. a、c电极均有单质生成它们的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷能形成众多单质与化合物。回答下列问题:
(1)磷在成键时,能将一个3s电子激发进入3d能级而参加成键,写出该激发态原子的核外电子排布式__ 。
(2)黑磷是一种二维材料,其中一层的结构如图1所示。
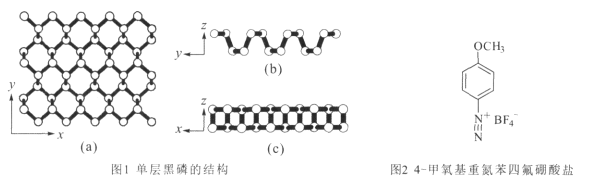
①黑磷中P原子的杂化方式为 _________ 。每一层内P形成六元环彼此相接,平均每个空间六元环中含有的磷原子是 ____个。
②用4-甲氧基重氮苯四氟硼酸盐(如图2)处理黑磷纳米材料,可以保护和控制其性质。
该盐的构成元素中C、N、O、F的电负性由大到小顺序为__,1mol该盐阳离子含有的σ键的数目为______ ,该盐阴离子的几何构型是__。
(3)磷钇矿可提取稀土元素钇(Y),某磷钇矿的结构如下:

该磷钇矿的化学式为__,与PO43—互为等电子体的阴离子有__ (写出两种离子的化学式)。已知晶胞参数a= 0.69 nm,c=0.60 nm,阿伏加德罗常数为NA,则该磷钇矿的密度为__g.cm—3(列出计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2S水溶液中存在电离平衡H2S![]() H++HS和HS
H++HS和HS![]() H++S2。若向H2S溶液中
H++S2。若向H2S溶液中
A. 滴加新制氯水,平衡向左移动,溶液pH减小
B. 加水,平衡向右移动,溶液中氢离子浓度增大
C. 通入过量SO2气体,平衡向左移动,溶液pH增大
D. 加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮氧化物是评价空气质量的控制标准之一,作为空气污染物的氮氧化物(NOx)常指NO和NO2。
(1)下列关于氮氧化物有关叙述不正确的是:_______(填序号)
①对人体及动物有毒害作用;②造成土壤污染;③一氧化氮可结合血红蛋白造成人体缺氧;④是形成酸雨、酸雾的主要原因之一; ⑤增高大气温度;⑥与碳氢化合物形成光化学烟雾;⑦参与臭氧层的破坏;⑧一氧化氮分子作为一种传递神经信息的 信使分子 ,在使血管扩张,免疫,增强记忆力
(2)用CH4催化还原NOx可在一定程度上消除氮氧化物的污染。
已知:CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2N2(g)+CO2(g)+2H2O(g)的ΔH=-1160kJ·mol-1
2NO2(g)+N2(g) ![]() 4NO(g) ΔH=+293 kJ·mol-1
4NO(g) ΔH=+293 kJ·mol-1
则该条件下,CH4催化还原NO2消除污染的热化学方程式为_______________。
(3)T1℃时,在刚性反应器中以投料比为1:3的NO(g)与O2(g)反应,其中NO2二聚为N2O4的反应可以迅速达到平衡。体系的总压强p随时间t的变化如下表所示[t=∞时,NO(g)完全反应]。
t/min | 0 | 40 | 80 | 160 | 260 | 700 | ∞ |
p/kPa | 32.8 | 30.7 | 29.9 | 29.4 | 29.2 | 28.8 | 26.9 |
①NO(g)与O2(g)合成的反应速率v=4.2×10-2×p2(NO)×p(O2)(kPa·min-1),t=42 min时,测得体系中p(O2)=22.4 kPa,则此时的v=_________kPa·min-1(计算结果保留1位小数)。
②若降低反应温度至T2℃,则NO(g)与O2(g)完全反应后体系压强p∞(T2℃)_________(填“大于”“等于”或“小于”)26.9kPa,原因是___________________________________。
③T1℃时,反应N2O4(g) ![]() 2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
2NO2(g)的平衡常数Kp=___kPa(Kp为以分压表示的平衡常数,是指平衡时体系中生成气体压强幂之积与反应物气体压强幂之积的比值。计算结果保留3位小数)。
(4)铈元素(Ce)是镧系金属中自然丰度最高的一种,常见有+3、+4两种价态。雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3-(两者物质的量之比为1:1)。可采用电解法将上述吸收液中的NO2-转化为无毒物质,同时再生Ce4+,其原理如图所示。

①Ce4+从电解槽的_____(填字母代号)口流出。
②写出阴极的电极反应式:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,一密闭容器被无摩擦、可滑动的两隔板a和b分成甲、乙两室。标准状况下,在乙室中充入0.6mol HCl,甲室中充入NH3、H2的混合气体,静止时活塞位置如图。已知甲、乙两室中气体的质量之差为10.9g。

(1)甲室中气体的物质的量为____mol
(2)甲室中气体的质量为____g
(3)甲室中NH3、H2的平均相对分子质量为___。
(4)经过查资料知道HCl+NH3=NH4Cl(NH4Cl常温下是固体),如果将板a去掉,当HCl与NH3完全反应后,活塞b将静置于刻度“___”处(填数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,两瓶气体所含原子数一定相等的是( )
A.同温度、同体积的H2和N2B.同体积、同密度的C2H4和CH4
C.同质量、不同密度的N2和COD.同压强、同体积的N2O和CO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com