
【题目】Ⅰ.2A![]() B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是________反应(填“放热”或“吸热”);
(2)若B为固体,减小压强平衡向逆反应方向移动,则A呈______态;
(3)若A、B、C均为气体,加入催化剂,平衡______移动(填“正向”、“逆向”或“不”)
Ⅱ.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
(1)用D表示的平均反应速率为____________,A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度____________(填“增大”、“减少”或“不变”)。
(3)若向原平衡体系再投入1 molA和1 mol B,平衡____________(填“右移、左移或不移”)。
Ⅲ.氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol。
2NH3(g);ΔH=-92.4 kJ/mol。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是____________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
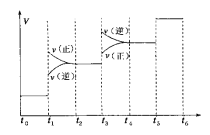
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
【答案】吸热 气 不 0.2mol/(L·min) 60% 增大 右移 增大压强 t2-t3 ![]()
【解析】
Ⅰ、(1)温度升高,平衡向吸热反应方向移动;
(2)降低压强平衡向气体体积增大的方向移动,据此判断;
(3)使用催化剂,缩短到达平衡的时间,平衡不移动;
Ⅱ、(1)根据v=![]() 计算D的生成速率,根据反应方程式计算A消耗的量,据此计算A的平衡转化率;
计算D的生成速率,根据反应方程式计算A消耗的量,据此计算A的平衡转化率;
(2)混合气体的密度为ρ=![]() ,反应前后气体质量守恒,m不变,据此分析;
,反应前后气体质量守恒,m不变,据此分析;
(3)根据反应物浓度增加,对平衡的影响分析;
III、①根据图象分析影响平衡的因素,主要是反应进行方向和速率的变化特征分析;
②化学平衡常数等于生成物浓度幂之积与反应物浓度幂之积的比,结合三段式进行计算。
Ⅰ、(1)温度升高,平衡向正反应方向移动,由于温度升高,平衡向吸热反应方向移动,故正反应为吸热反应;
(2)B为固体,降低压强平衡向逆反应方向移动,由于降低压强平衡向气体体积增大的方向移动,故逆反应为气体体积增大的反应,故A为气态;
(3)使用催化剂,缩短到达平衡的时间,不影响平衡移动;
Ⅱ、一定温度下将2molA和2molB两种气体混合于2L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,则
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8molD,则
3A(g)+B(g)![]() 2C(g)+2D(g)
2C(g)+2D(g)
起始(mol) 2 2 0 0
转化(mol) 1.2 0.4 0.8 0.8
平衡(mol) 0.8 1.6 0.8 0.8
(1)用D表示的平均反应速率为v=![]() =
= =0.2mol/(L·min);A的转化率为α=
=0.2mol/(L·min);A的转化率为α=![]() =60%;
=60%;
(2)混合气体的密度为ρ=![]() ,反应前后气体质量守恒,m不变,缩小容器体积,则V变小,混合气体的密度增大;
,反应前后气体质量守恒,m不变,缩小容器体积,则V变小,混合气体的密度增大;
(3)增加反应物浓度,平衡会正向移动,即向右移动;
Ⅲ、N2(g)+3H2(g)![]() 2NH3(g)△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
2NH3(g)△H=-92.4kJ/mol;反应是放热反应,反应前后气体体积减小,
①由反应速率与时间的关系图象可知,t1时正逆反应速率都增大,平衡正向移动,引起平衡移动的条件可能是增大压强;t3时刻正逆反应速率均迅速增大,但是平衡逆向进行,所以氨气的百分含量是减小的,即表示平衡混合物中NH3的含量最高的一段时间是t2~t3;
② N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
起始(mol/L) 2a 4a 0
反应(mol/L) a 3a 2a
平衡(mol/L
所以化学平衡常数K=![]() =
=![]() 。
。


 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡: CH3COOH ![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入水时,平衡向逆反应方向移动
B. 加入少量NaOH固体,平衡向正反应方向移动
C. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)减小
D. 加入少量CH3COONa固体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是重要的资源,可以制备一系列物质,
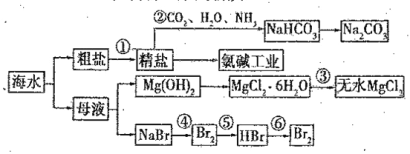
下列说法正确的是( )
A.步骤②中,应先通CO2 ,再通NH3
B.步骤③可将MgCl2·6H2O晶体在空气中直接加热脱水
C.步骤④、⑤、⑥反应中,溴元素均被氧化
D.除去粗盐中的 SO42-、Ca2+ 、Mg2+ 等杂质,加入试剂及相关操作顺序可以是:NaOH溶液→BaCl2 溶液→Na2CO3 溶液→过滤→盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
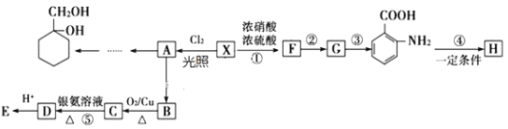
【题目】芳香烃X是一种重要的有机化工原料,相对分子质量为92。以它为初始原料可以获得如下图的系列有机产物![]() 部分产物、合成路线、反应条件略去
部分产物、合成路线、反应条件略去![]() ,H是一种功能高分子。
,H是一种功能高分子。
已知: I. ![]()
![]()
![]()
II.![]()
![]()
![]()
![]() 苯胺,易被氧化
苯胺,易被氧化![]()
请根据所学知识与本题所给信息回答问题:
(1)F的名称为_______。A共平面的原子数最多为_____个。
(2)反应![]() 的类型是 _______ 。
的类型是 _______ 。
(3)H含有的官能团名称为 _________ 。
(4)反应![]() 的化学方程式是 _________ 。
的化学方程式是 _________ 。
(5)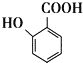 有多种同分异构体,其中能发生银镜反应且能使FeCl3溶液显紫色的有机物有___种。
有多种同分异构体,其中能发生银镜反应且能使FeCl3溶液显紫色的有机物有___种。
(6)写出用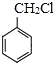 和其他无机化合物合成
和其他无机化合物合成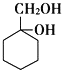 的合成线路_____________。
的合成线路_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )
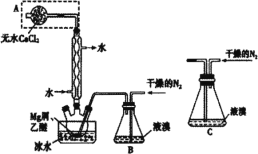
A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.1000mol·L-1NaOH溶液滴定20mL0.1000mol·L-1一元酸HA(pKa=-lgKa=4.75)溶液,其滴定曲线如图所示。下列说法正确的是
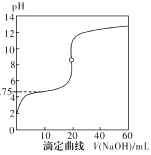
A.当滴入40mLNaOH溶液时,溶液中:c(Na+)>c(A-)>c(OH-)>c(H+)
B.当溶液中c(H+)+c(OH-)=2×10-7时:c(Na+)>c(A-)>c(OH-)=c(H+)
C.当滴入NaOH溶液20mL时c(OH-)>c(H+)+c(HA)
D.当滴定到pH=4.75时,c(A-)=c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 电解NaClO3溶液时阳极反应式为ClO3-+H2O-2e-=C1O4-+2H+
D. 该流程中可循环利用的物质是NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCN)是一种基本化工原料,同时也是一种毒物质。一旦泄漏需要及时处理,一般可以通过喷酒双氧水或过硫酸钠(Na2S2)溶液来处理,以减少对环境的污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________________________________。
II.工业制备过硫酸钠的反应原理如下所示
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
某化学小组利用上述原理在实验室制备过硫酸,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。
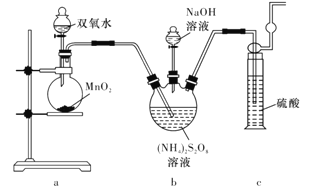
(2)装置中盛放(NH4)2S2O8溶液的仪器的名称是____________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是____________________。
(4)上述装置中还需补充的实验仪器或装置有______________(填字母代号)。
A.温度计 B水浴加热装置
C.洗气瓶 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氯化钠的含量。
已知;①废水中氯化钠的最高排放标准为0.50mg/L。
②Ag++2CN—===[Ag(CN)2]—,Ag++I—==AgI↓,AgI呈黄色,CN—优先与Ag+发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0![]() 10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
(5)滴定终点的现象是___________________________________。
(6)处理后的废水中氰化钠的浓度为____________________mg/L.
Ⅲ.(7)常温下,含硫微粒的主要存在形式受pH的影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4—,则阳极主要的反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是
A. 反应剧烈程度:两者相同
B. 消耗硝酸的物质的量:前者多,后者少
C. 反应生成气体的颜色:前者浅,后者深
D. 反应中转移的电子总数:前者多,后者少
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com