
【题目】无水MgBr2可用作催化剂。某兴趣小组同学采用镁屑与液溴为原料制备无水MgBr2,设计装置如图所示。已知:Mg与Br2反应剧烈放热;MgBr2具有强吸水性。下列说法正确的是( )
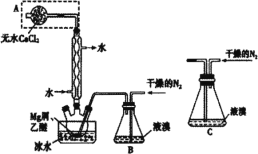
A.冷凝管中冷水进、出口方向错误
B.实验中可以用干燥的空气代替干燥的N2
C.为防止反应过于剧烈,不能用装置C代替装置B
D.装有无水CaCl2固体A的作用是吸收挥发的溴蒸气,防止污染环境
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:
【题目】(1)北京奥运会祥云火炬将中国传统文化、奥运精神以及现代高科技融为一体。火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料。试回答下列问题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,请在图中的括号内填入“+”或“” ___。
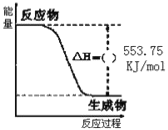
②写出表示丙烷燃烧热的热化学方程式:___。
③二甲醚(CH3OCH3)是一种新型燃料,应用前景广阔。1mol二甲醚完全燃烧生成CO2和液态水放出1455kJ热量。若1mol丙烷和二甲醚的混合气体完全燃烧生成CO2和液态水共放出1645kJ热量,则混合气体中,丙烷和二甲醚的物质的量之比为___。
(2)盖斯定律认为:不管化学过程是一步完成或分数步完成,整个过程的总热效应相同。试运用盖斯定律回答下列问题:
①已知:H2O(g)═H2O(l) △H1=Q1kJ/mol
C2H5OH(g)═C2H5OH(l) △H2=Q2kJ/mol
C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g) △H3=Q3kJ/mol
若使23g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为___kJ。
②碳(s)在氧气供应不充分时,生成CO同时还部分生成CO2,因此无法通过实验直接测得反应:C(s)+![]() O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
O2(g)═CO(g)的△H.但可设计实验、利用盖斯定律计算出该反应的△H,计算时需要测得的实验数据有___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化铝和氢氧化铝的叙述错误的是( )
A. Al(OH)3受热能分解
B. Al2O3既能溶于强酸溶液又能溶于强碱溶液
C. Al(OH)3胶体能吸附水中的悬浮物
D. Al(OH)3与过量的浓氨水反应生成NH4[Al(OH)4]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼![]() 最重要的用途是作为铁合金的添加剂,用CO还原
最重要的用途是作为铁合金的添加剂,用CO还原![]() 制备单质Mo的装置如图所示
制备单质Mo的装置如图所示![]() 尾气处理装置已省略
尾气处理装置已省略![]() 下列说法正确的是
下列说法正确的是![]()
![]()
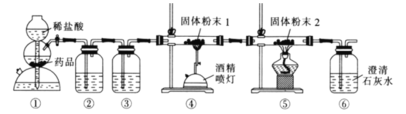
A.装置![]() 中的药品为石灰石粉末
中的药品为石灰石粉末
B.装置![]() 中盛有饱和碳酸氢钠溶液,
中盛有饱和碳酸氢钠溶液,![]() 中盛有澄清石灰水
中盛有澄清石灰水
C.在装置![]() 中生成了钼单质
中生成了钼单质
D.![]() 中溶液变浑浊,说明产生的
中溶液变浑浊,说明产生的![]() 一定是来自
一定是来自![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验方案不能达到实验目的的是
选项 | 实验方案 | 实验目的 |
A. | 向酸性 | 验证草酸具有还原性 |
B. | 向相同浓度的NaBr和KI溶液中分别滴加足量氯水,观察溶液颜色变化 | 比较溴元素和碘元素的非金属性强弱 |
C. | 将铜与浓硝酸反应生成的气体收集后用冰水混合物冷却降温 | 研究温度对化学平衡的影响 |
D. | 将 | 制备硫酸镁晶体 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.2A![]() B+C在某一温度时,达到平衡。
B+C在某一温度时,达到平衡。
(1)若温度升高,平衡向正反应方向移动,则正反应是________反应(填“放热”或“吸热”);
(2)若B为固体,减小压强平衡向逆反应方向移动,则A呈______态;
(3)若A、B、C均为气体,加入催化剂,平衡______移动(填“正向”、“逆向”或“不”)
Ⅱ.在一定温度下将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生如下反应:3A(g)+B(g)![]() 2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
2C(g)+2D(g),2分钟末反应达到平衡状态,生成了0.8 mol D,请填写下列空白。
(1)用D表示的平均反应速率为____________,A的转化率为____________。
(2)如果缩小容器容积(温度不变),则平衡体系中混合气体的密度____________(填“增大”、“减少”或“不变”)。
(3)若向原平衡体系再投入1 molA和1 mol B,平衡____________(填“右移、左移或不移”)。
Ⅲ.氢气是合成氨的重要原料,合成氨反应的热化方程式如下:N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ/mol。
2NH3(g);ΔH=-92.4 kJ/mol。
①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。图中t1时引起平衡移动的条件可能是____________,其中表示平衡混合物中NH3的含量最高的一段时间是____________。
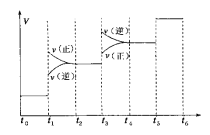
②温度为T ℃时,将2 a mol H2和a mol N2放入0.5 L密闭容器中,充分反应后测得N2的转化率为50%。则反应的平衡常数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,室温下向盛有3.0mL NO的试管中缓缓通入1.5mL O2(所有气体的体积均在标准状况下测定)。
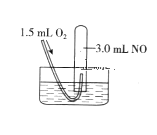
试回答下列问题:
(1)写出观察到的现象(可不写满,也可补充):
①__________;
②__________;
③__________。
(2)上述过程中发生反应的化学方程式有__________。
(3)最终试管中剩余的气体是__________,体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组利用以下装置制取并探究氨气的性质。在A装置中发生反应的化学方程式为2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O。
CaCl2+2NH3↑+2H2O。
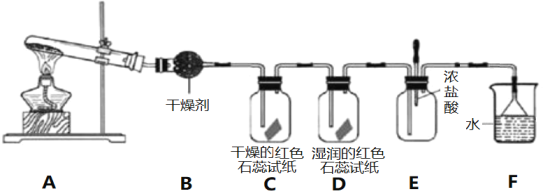
(1)B装置中的干燥剂是_________________(填“碱石灰”或“浓硫酸”)。
(2)C、D装置中试纸颜色会发生变化的是___________(填”C”或“D”)。
(3)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1-2滴浓盐酸,可观察到E装置中的现象是产生_____________(填”白烟”或“白雾”)。
(4)烧杯F中水的作用是________________________。
(5)欲制得标准状况下11.2 LNH3,至少需要Ca(OH)2的质量为____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)NH4Cl溶液显_________性,用离子方程式表示原因____________,其溶液中离子浓度大小顺序为_______________________________________。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)=________ ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)=_________________。
(3)若将等pH、等体积的NaOH和NH3·H2O分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m__________n(填“<”、“>”或“=”)。
(4)物质的量浓度相同的NaCl;NaOH;HCl;④NH4Cl;⑤CH3COONa 5种溶液按pH由大到小的顺序为(用④⑤代表相应溶液):_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com