
【题目】氯化钠(NaCN)是一种基本化工原料,同时也是一种毒物质。一旦泄漏需要及时处理,一般可以通过喷酒双氧水或过硫酸钠(Na2S2)溶液来处理,以减少对环境的污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________________________________。
II.工业制备过硫酸钠的反应原理如下所示
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
某化学小组利用上述原理在实验室制备过硫酸,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。
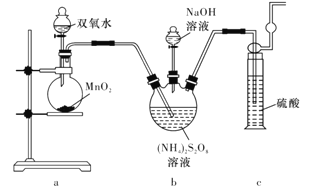
(2)装置中盛放(NH4)2S2O8溶液的仪器的名称是____________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是____________________。
(4)上述装置中还需补充的实验仪器或装置有______________(填字母代号)。
A.温度计 B水浴加热装置
C.洗气瓶 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氯化钠的含量。
已知;①废水中氯化钠的最高排放标准为0.50mg/L。
②Ag++2CN—===[Ag(CN)2]—,Ag++I—==AgI↓,AgI呈黄色,CN—优先与Ag+发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0![]() 10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
(5)滴定终点的现象是___________________________________。
(6)处理后的废水中氰化钠的浓度为____________________mg/L.
Ⅲ.(7)常温下,含硫微粒的主要存在形式受pH的影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4—,则阳极主要的反应式为_________________________。
【答案】NaCN+H2O2+H2O=NH3↑+NaHCO3 三颈烧瓶 将产生的氨气及时排出并被吸收,防止产生倒吸,减少发生副反应 AB 滴入最后一滴标准硝酸银溶液,锥形瓶的溶液中恰好产生黄色沉淀,且半分钟内沉淀不消失 0.49 2HSO4—-2e-=S2O82—+2H+
【解析】
I. 由题意,NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明NaCN与双氧水发生氧化还原反应生成了NaHCO3和NH3;
II. 装置b中过二硫酸铵与氢氧化钠在55℃温度下反应生成过二硫酸钾、氨气和水,装置a中双氧水在二氧化锰的催化作用下,发生分解反应生成02,反应生成的02将三颈烧瓶中产生的NH3及时排出被硫酸吸收,防止产生倒吸;避免氨气与过二硫酸钠发生副反应;滴定过程中Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀;
Ⅲ. 由题意可知,HSO4—在阳极失电子发生氧化反应生成S2O82—。
(1)由题意,NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,说明NaCN与双氧水发生氧化还原反应生成了NaHCO3和NH3,反应的化学方程式为NaCN+H2O2+H2O=NH3↑+NaHCO3,故答案为:NaCN+H2O2+H2O=NH3↑+NaHCO3;
(2)由图可知,盛放(NH4)2S2O8溶液的仪器的名称是三颈烧瓶,故答案为:三颈烧瓶;
(3)由题给信息可知,过二硫酸铵与氢氧化钠在55℃温度下反应生成过二硫酸钾、氨气和水,反应生成的氨气在90℃温度下与过二硫酸钠发生副反应生成硫酸钠、氮气和水,装置a中双氧水在二氧化锰的催化作用下,发生分解反应生成02,反应生成的02将三颈烧瓶中产生的NH3及时排出被硫酸吸收,防止产生倒吸;避免氨气与过二硫酸钠发生副反应,故答案为:将产生的氨气及时排出并被吸收,防止产生倒吸,减少发生副反应;
(4)由题给信息可知,制备反应需要在55℃温度下进行,90℃温度下发生副反应,所以需要控制温度不能超过90℃,故还需补充的实验仪器或装置为温度计和水浴加热装置,故答案为:AB;
(5)滴定过程中Ag+与CN-反应生成[Ag(CN)2]-,当CN-反应结束时,滴入最后一滴硝酸银溶液,Ag+与I-生成AgI黄色沉淀,且半分钟内沉淀不消失,说明反应到达滴定终点,故答案为:滴入最后一滴标准硝酸银溶液,锥形瓶的溶液中恰好产生黄色沉淀,且半分钟内沉淀不消失;
(6)滴定终点时消耗AgNO3的物质的量为1.0×10—3mol/L×5.00×10—3L=5.00×10-6mol,根据方程式Ag++2CN-=[Ag(CN)2]-可知处理的废水中氰化钠的质量为5.00×10-6mol×2×49g/mol=4.9×10-4g,则处理后的废水中氰化钠的浓度为![]() =0.49 mg/L,故答案为:0.49;
=0.49 mg/L,故答案为:0.49;
(7)由题意可知,HSO4—在阳极失电子发生氧化反应生成S2O82—,电极反应式为2HSO4—-2e-=S2O82—+2H+,故答案为:2HSO4—-2e-=S2O82—+2H+。


科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应又属于置换反应的是( )
A.CuO+H2![]() Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2O
Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+3CO![]() 2Fe+3CO2D.2Na2O2+2H2O=4NaOH+O2↑
2Fe+3CO2D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LNaA溶液中滴滴加盐酸,遇得混合溶液的pH与![]() 的变化关系如下图所示,
的变化关系如下图所示,![]() 下列叙述正确的是
下列叙述正确的是
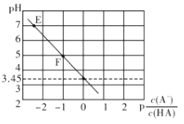
A. E点溶液中c(Na+)=c(A—)
B. Ka(HA)的数量级为10—3
C. 滴加过程中![]() 保持不变
保持不变
D. F点溶液中c(Na+)>c(HA)>c(A—)>c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是
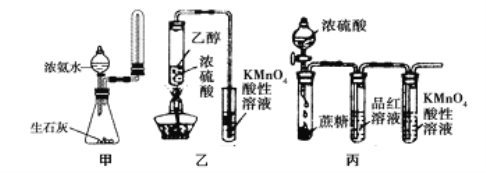
A. 实验室用图甲所示装置制取少量氨气
B. 为使100mL0.5mol/L的NaNO3溶液物质的量浓度变为1mol/L,可将原溶液加热蒸发掉50mL水
C. 利用图乙装置,可制取乙烯并验证其易被酸性KMnO4溶液氧化
D. 利用图丙装置,可说明浓H2SO4具有脱水性、强氧化性,SO2具有漂白性、还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家构建了一种有机框架物M,结构如图。下列说法错误的是( )
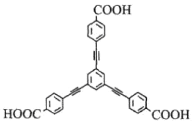
A. 1molM可与足量Na2CO3溶液反应生成1.5molCO2
B. 苯环上的一氯化物有3种
C. 所有碳原子均处同一平面
D. 1molM可与15mol H2发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂,有关数据如下:
C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl,C6H4Cl2,苯,易吸水 | ||
熔点/℃ | -45 | 53 | — | — |
沸点/℃ | 132 | 173 | — | — |
实验室可以用多种方法来制备无水FeCl2。回答下列问题:
Ⅰ.按下如图装置用H2还原无水FeCl3制取。
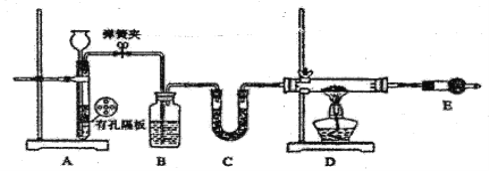
(1)用装置A制取H2,其优点是________________;D中反应的化学方程式为____________________;装置E的作用是____________________________。
(2)通入足量H2,充分反应,如果温度控制不当,产品中会含单质铁,检验产品中是否含铁的方案是____________________________。
Ⅱ.按图装置,在三颈烧瓶中放入162.5g无水氯化铁和225g氯苯,控制反应温度在128℃~139℃加热3h,反应接近100%。反应如下:2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl
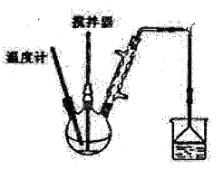
(3)上述反应中,还原剂是____________。
(4)反应温度接近或超过C6H5Cl的沸点,但实验过程中C6H5Cl并不会大量损失,原因是____________________________。
(5)冷却后,将三颈瓶内物质经过过滤,洗涤,干燥后,得到粗产品。
①洗涤所用的试剂可以是____________________________;
②简述回收滤液中C6H5Cl的方案____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A和C为原料合成治疗多发性硬化症药物H的路线如下:
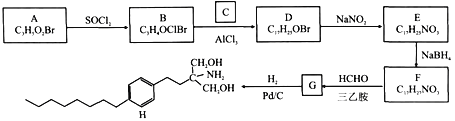
已知:
①A能与NaHCO3溶液反应放出CO2,其核磁共振氢谱显示有三组峰,峰面积比为2:2:1。
②NaBH4能选择性还原醛、酮,而不还原—NO2。

回答下列问题:
(1)A的化学名称为________,D的结构简式为_______。
(2)H的分子式为_______,E中官能团的名称为_______。
(3)B→D、E→F的反应类型分别为_______。
(4)F→G的化学方程式为________。
(5)与C互为同分异构体的有机物的结构简式为_______(核磁共振氢谱为四组峰,峰面积比为6:3:1:1)。
(6)设计由B和![]() 为原料制备具有抗肿瘤活性药物
为原料制备具有抗肿瘤活性药物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发展“碳一化学”,开发利用我国丰富的煤炭资源具有重要的战略意义和经济价值。请回答下列问题:
(1)已知:常温下C(s)的燃烧热△H=-393.5 kJ·mol-1, S(s)的燃娆热△H=-296.0 kJ·mol-l ,CO2(g)+C(S)=2CO(g) △H=+172.5 kJ·mol-1,写出一氧化碳将二氧化硫还原为单质硫的热化学方程式:______
(2)在763 K、3.04×104 kPa时,用CO和H2做原料合成甲醇(CH3OH),存在下列平衡:CO(g)+2H2(g) ![]() CH3OH(g)。当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
CH3OH(g)。当原料中CO和H2的比例不同时,对CO的转化率及平衡混合物中甲醇的体积分数都有影响。
①设H2和CO起始物质的量之比为m,平衡时CO的转化率为α,平衡混合物中甲醇的体积分数为y,则m、α、y三者的关系式为y=___。
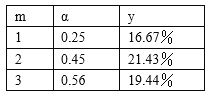
②根据表中提供的数据,可得出反应物的比例对CO的平衡转化率以及平衡混合物中甲醇的体积分数影响的结论,选择最佳反应物配比m=_______(填“l”、“2”或“3”),理由是_________。
(3)如图是四种金属氧化物被一氧化碳还原,反应达到平衡时lgc(CO)/c(CO2)与温度(T)的关系曲线图:

①8000C时,其中最易被还原的金属氧化物是______(填化学式),该反应的平衡常数K=_______。
②CO2还原PbO2的反应△H ___0(填“>”或“<”)。判断依据是_________。
(4)科学家正在研究用固态物质作为火箭推进剂。固体推进剂(硝酸钾和蔗糖的混合物)点燃后在燃烧室里燃烧,发生反应KNO3+C12H22O11→CO2↑+N2↑+H2O+K2CO3,(未配平)。则该反应中氧化剂与还原剂的物质的量之比是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com