
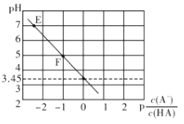
【题目】25℃时,向0.1mol/LNaA溶液中滴滴加盐酸,遇得混合溶液的pH与![]() 的变化关系如下图所示,
的变化关系如下图所示,![]() 下列叙述正确的是
下列叙述正确的是
A. E点溶液中c(Na+)=c(A—)
B. Ka(HA)的数量级为10—3
C. 滴加过程中![]() 保持不变
保持不变
D. F点溶液中c(Na+)>c(HA)>c(A—)>c(OH—)
【答案】C
【解析】
由图可知,E点溶液pH为7,溶液中c(H+)=c(OH—),
A项、由图可知,E点溶液pH为7,溶液中c(H+)=c(OH—),由溶液中电荷守恒关系c(Na+)+ c(H+)=c(A—)+ c(Cl—)+ c(OH—)可知,溶液中c(Na+)=c(A—)+ c(Cl—),故A错误;
B项、HA的电离常数Ka(HA)=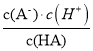 ,由图可知pH为3.45时,溶液中
,由图可知pH为3.45时,溶液中![]() =0,c(HA)=c(A—),则Ka(HA)= c(H+)=10-3.45,Ka(HA)的数量级为10—4,故B错误;
=0,c(HA)=c(A—),则Ka(HA)= c(H+)=10-3.45,Ka(HA)的数量级为10—4,故B错误;
C项、溶液中![]() =
=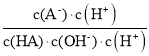 =
=![]() ,温度不变,水的离子积常数、弱酸的电离常数不变,则滴加过程中
,温度不变,水的离子积常数、弱酸的电离常数不变,则滴加过程中![]() 保持不变,故C正确;
保持不变,故C正确;
D项、F点溶液pH为5,![]() =—1,则溶液中c(A—)>c(HA),由物料守恒c(Na+)=c(A—)+ c(HA)可知c(Na+)>c(A—),则溶液中离子浓度大小顺序为c(Na+)>c(A—)>c(HA)>c(OH—),故D错误。
=—1,则溶液中c(A—)>c(HA),由物料守恒c(Na+)=c(A—)+ c(HA)可知c(Na+)>c(A—),则溶液中离子浓度大小顺序为c(Na+)>c(A—)>c(HA)>c(OH—),故D错误。
故选C。


科目:高中化学 来源: 题型:
【题目】氢氧化铈[Ce(OH)4]是一种重要的稀土氢氧化物。平板电视显示屏生产过程中会产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2),某课题组以此粉末为原料回收铈,设计实验流程如下:
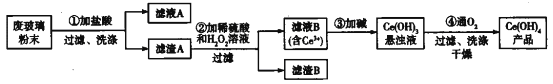
下列说法错误的是
A. 滤渣A中主要含有SiO2、CeO2
B. 过滤操作中用到的玻璃仪器有烧杯、漏斗、玻璃棒
C. 过程②中发生反应的离子方程式为CeO2+H2O2+3H+=Ce3++2H2O+O2↑
D. 过程④中消耗 11.2L O2(已折合成标准状况),转移电子数为2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子。
(1)Y与Z可形成多种化合物。
① 元素Y与Z中电负性较大的是________(用元素符号描述)。
② 离子ZY32-的空间构型为________(用文字描述)。
③ 写出一种与ZY2互为等电子体的分子的化学式:________。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为______。
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式为______。
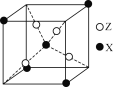
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石油裂化和裂解得到的乙烯、丙烯合成丙烯酸乙酯的路线如图所示:
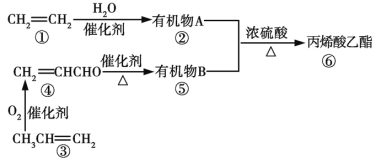
已知:—CHO![]() —COOH
—COOH
下列判断正确的是
A. 生成有机物⑥的原子利用率为100%
B. 有机物①②③④⑤⑥在一定条件下均可发生加聚反应
C. 丙烯酸乙酯在稀硫酸中不能发生水解反应
D. 有机物③④在一定条件下发生加聚反应可得![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某有机化合物A的结构,进行如下实验:
I. 分子式的确定:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4g H2O和8.8g CO2,消耗氧气6.72L(标准状况下),则该物质的实验式是__________.
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图①所示质谱图,则其相对分子质量为__________,该物质的分子式是__________.
(3)根据价键理论,预测A的可能结构并写出结构简式__________.
II.结构式的确定:
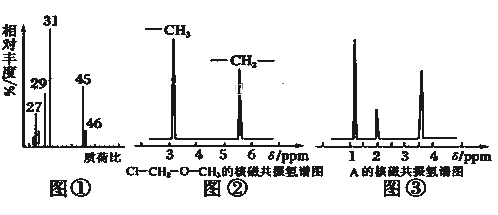
(4)核磁共振氢谱能对有机物分子中不同位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目.例如:甲基氯甲基醚(Cl﹣CH2﹣O﹣CH3)有两种氢原子如图②.经测定,有机物A的核磁共振氢谱示意图如图③,则A的结构简式为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCN)是一种基本化工原料,同时也是一种毒物质。一旦泄漏需要及时处理,一般可以通过喷酒双氧水或过硫酸钠(Na2S2)溶液来处理,以减少对环境的污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________________________________。
II.工业制备过硫酸钠的反应原理如下所示
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
某化学小组利用上述原理在实验室制备过硫酸,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。
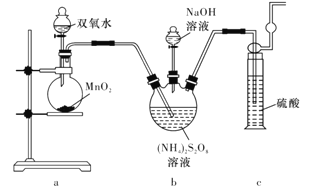
(2)装置中盛放(NH4)2S2O8溶液的仪器的名称是____________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是____________________。
(4)上述装置中还需补充的实验仪器或装置有______________(填字母代号)。
A.温度计 B水浴加热装置
C.洗气瓶 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氯化钠的含量。
已知;①废水中氯化钠的最高排放标准为0.50mg/L。
②Ag++2CN—===[Ag(CN)2]—,Ag++I—==AgI↓,AgI呈黄色,CN—优先与Ag+发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0![]() 10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
(5)滴定终点的现象是___________________________________。
(6)处理后的废水中氰化钠的浓度为____________________mg/L.
Ⅲ.(7)常温下,含硫微粒的主要存在形式受pH的影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4—,则阳极主要的反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无色透明溶液中可能含有以下离子中的几种:Na+、K+、NH4+、Ag+、Mg2+、Cu2+、Cl-、CO32-、SO42-且所含的各离子物质的量浓度相等;取三份进行如下实验:
①向第一份中加入足量BaCl2溶液,得到白色沉淀,过滤后用盐酸洗涤沉淀,结果沉淀消失
②向第二份加入足量硝酸酸化的AgNO3溶液,溶液出现白色沉淀
③向第三份加入足量NaOH溶液并加热,收集到一定体积的气体,但溶液依然澄清
试回答下列问题:
(1)肯定存在的离子有______________________
(2)写出①中发生的离子反应方程式________________,___________________
(3)写出②中发生的离子反应方程式________________,___________________
(4)写出③中发生的离子反应方程式_________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N、Fe是两种重要的元素,其单质及化合物在诸多领域中都有广泛的应用。
(1)基态N原子最高能级的电子云轮廓图形状是__________,其核外有______种不同运动状态的电子。
(2)第一电离能N_____O(填“>”“<”或“=”),其原因是_______________________。
(3)在高压下氮气会发生聚合得到高聚氮。晶体中每个氮原子与另外三个氮原子结合形成空间网状结构。高聚氮的晶体类型是__________,氮原子的杂化轨道类型为__________。
(4)六方氮化硼(BN)与石墨晶体结构类似,硼原子和氮原子交替相连,但石墨可以导电而六方BN却不能导电,其原因是_____________________________。
(5)叠氮酸(HN3)在生产生活中有着重要应用。叠氮酸(HN3)可用HNO2氧化肼(N2H4)制得,化学方程式是N2H4 + HNO2=HN3 + 2H2O。下列叙述错误的是_________。
A.HN3和N2H4都是由极性键和非极性键构成的非极性分子
B.NaN3的晶格能大于KN3的晶格能
C.HN3分子中四个原子可能在一条直线上
D.叠氮酸(HN3)和水能形成分子间氢键
(6)某种离子型铁的氧化物晶胞如图所示,它由A、B方块组成。则该化合物中Fe2+、Fe3+、O2-的个数比是__________(填最简整数比);已知该晶体的晶胞参数为a nm,阿伏加德罗常数的值为NA,则该晶体的密度是_______ g![]() cm-3(用含a和NA的代数式表示)。
cm-3(用含a和NA的代数式表示)。
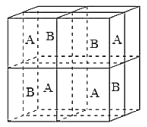
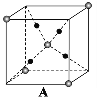
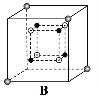
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com