
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子。
(1)Y与Z可形成多种化合物。
① 元素Y与Z中电负性较大的是________(用元素符号描述)。
② 离子ZY32-的空间构型为________(用文字描述)。
③ 写出一种与ZY2互为等电子体的分子的化学式:________。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为______。
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式为______。
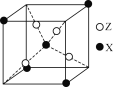
【答案】O 三角锥形 S2O或SeO2 H2O分子与乙醇分子间可形成氢键,而H2S不能 14 mol Fe3S8
【解析】
元素X位于第四周期,其基态原子有4个未成对电子,核外电子排布式为1s22s22p63s23p63d64s2,则X为Fe;Y原子最外层电子数是其内层电子总数的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;元素Z基态原子的3p轨道上有4个电子,核外电子排布式为1s22s22p63s23p4,则Z为S元素,据此答题。
(1)①同主族自上而下电负性减小,故电负性O>S,故答案为:O。
②离子SO32-中S原子孤电子对数=(6+2-2×3)÷2=1,价层电子对数=3+1=4,为三角锥形,故答案为:三角锥形。
③原子数目相等、价电子总数也相等的微粒互为等电子体,则一种与SO2互为等电子体的氧化物分子的化学式为:SeO2或S2O,故答案为:SeO2或S2O。
(2)H2O分子与乙醇分子间可形成氢键,而H2S不能,H2O在乙醇中的溶解度大于H2S,
故答案为:H2O分子与乙醇分子间可形成氢键,而H2S不能。
(3)氨气分子中有3个σ键,CN-中含有1个σ键,形成6个配位键,也属于σ键,1mol配合物K3[Fe(CN)5(NH3)]中含14molσ键,故答案为:14mol。
(4)根据均摊法,晶胞中S原子数目为4,Fe原子数目为1+4×1/8=1.5,Fe、S原子数目之比为3:8,故化学式为:Fe3S8,故答案为:Fe3S8。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】[2019·武汉市武昌区高三五月调研考试]室温下,用0.100 mol·L1的NaOH溶液分别滴定均为20.00mL0.100 mol·L1的HCl溶液和醋酸溶液,滴定曲线如图所示。下列说法正确的是
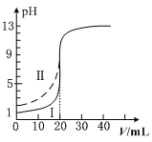
A. Ⅰ表示的是滴定醋酸的曲线
B. pH=7时,滴定醋酸消耗的V(NaOH)>20.00mL
C. V(NaOH)=20.00mL时,两份溶液中c(Cl-)>c(CH3COO-)
D. V(NaOH)=10.00mL时,醋酸中c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018 年 5 月美国研究人员成功实现在常温常压下用氮气和水生产氨,原理如下图所示:

下列说法正确的是
A.图中能量转化方式只有 2 种
B.b 极发生的电极反应为:N2+6H++6e-= 2NH3
C.H+向 a 极区移动
D.a 极上每产生 22.4L O2 流过电极的电子数为 2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AA705合金(含Al、Zn、Mg和Cu)几乎与钢一样坚固,但重量仅为钢的三分之一,已被用于飞机机身和机翼、智能手机外壳上等。但这种合金很难被焊接。最近科学家将碳化钛纳米颗粒(大小仅为十亿分之一米)注入AA7075的焊丝内,让这些纳米颗粒充当连接件之间的填充材料。注入了纳米粒子的填充焊丝也可以更容易地连接其他难以焊接的金属和金属合金。回答下列问题:
(1)基态铜原子的价层电子排布式为__________。
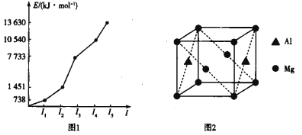
(2)第三周期某元素的前5个电子的电离能如图1所示。该元素是_____(填元素符号),判断依据是_______。
(3)CN—、NH3、H2O和OH—等配体都能与Zn2+形成配离子。1mol [Zn(NH3)4]2+含___ molσ键,中心离子的配位数为_____。
(4)铝镁合金是优质储钠材料,原子位于面心和顶点,其晶胞如图2所示。1个铝原子周围有_____个镁原子最近且等距离。
(5)在二氧化钛和光照条件下,苯甲醇可被氧化成苯甲醛:

①苯甲醇中C原子杂化类型是__________。
②苯甲醇的沸点高于苯甲醛,其原因是__________。
(6)钛晶体有两种品胞,如图所示。
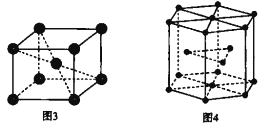
①如图3所示,晶胞的空间利用率为______(用含п的式子表示)。
②已知图4中六棱柱边长为x cm,高为y cm。该钛晶胞密度为D g·cm-3,NA为______mol—1(用含x y和D的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化氨基汞[Hg(NH2)Cl]是祛斑霜中常用的添加剂,可由反应:Hg+2NH3+Cl2==Hg(NH2)Cl↓+NH4Cl制备,某学习小组在实验室中利用下列装置制备氯化氨基汞,回答下列问题。
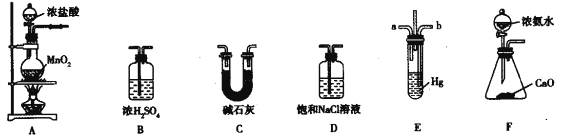
(1)A中发生反应的离子方程式为____________。
(2)F中发生反应的化学方程式为_________。
(3)盛装碱石灰的仪器名称为________,其作用为__________。
(4)整个装置的仪器连接顺序为A→________(装置不能重复使用)。该实验的不足之处是__________。
(5)E中短导管a通入的气体是__________,导管ab采用长短不同的原因是__________。
(6)氯化氨基汞产品中氯化氨基汞的含量测定:称取ag样品,加入水及稀硫酸溶解向溶解后的溶液中加入0.1mol/L KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知Hg2++2I—=HgI2↓(橙红色),HgI2+2I—=HgI42—(无色)],共消耗V mL KI溶液。测定产品中氯化氨基汞的质量分数为__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸分子的结构式为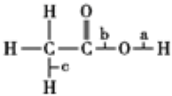 ,下列反应及断键部位正确的是
,下列反应及断键部位正确的是
①乙酸的电离,是a键断裂
②乙酸与乙醇发生酯化反应,是b键断裂
③在红磷存在时,Br2与CH3COOH的反应:CH3COOH+Br2![]() CH2Br—COOH+HBr,是c键断裂
CH2Br—COOH+HBr,是c键断裂
④乙酸变成乙酸酐的反应:2CH3COOH ![]()
![]() +H2O,是a、b键断裂
+H2O,是a、b键断裂
A. 仅①②③ B. ①②③④ C. 仅②③④ D. 仅①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既属于氧化还原反应又属于置换反应的是( )
A.CuO+H2![]() Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2O
Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+3CO![]() 2Fe+3CO2D.2Na2O2+2H2O=4NaOH+O2↑
2Fe+3CO2D.2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向0.1mol/LNaA溶液中滴滴加盐酸,遇得混合溶液的pH与![]() 的变化关系如下图所示,
的变化关系如下图所示,![]() 下列叙述正确的是
下列叙述正确的是
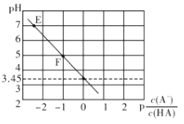
A. E点溶液中c(Na+)=c(A—)
B. Ka(HA)的数量级为10—3
C. 滴加过程中![]() 保持不变
保持不变
D. F点溶液中c(Na+)>c(HA)>c(A—)>c(OH—)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由A和C为原料合成治疗多发性硬化症药物H的路线如下:
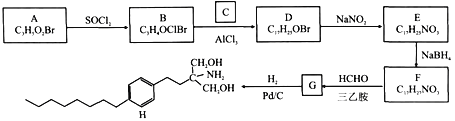
已知:
①A能与NaHCO3溶液反应放出CO2,其核磁共振氢谱显示有三组峰,峰面积比为2:2:1。
②NaBH4能选择性还原醛、酮,而不还原—NO2。

回答下列问题:
(1)A的化学名称为________,D的结构简式为_______。
(2)H的分子式为_______,E中官能团的名称为_______。
(3)B→D、E→F的反应类型分别为_______。
(4)F→G的化学方程式为________。
(5)与C互为同分异构体的有机物的结构简式为_______(核磁共振氢谱为四组峰,峰面积比为6:3:1:1)。
(6)设计由B和![]() 为原料制备具有抗肿瘤活性药物
为原料制备具有抗肿瘤活性药物 的合成路线__________。
的合成路线__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com