
【题目】下列反应中,既属于氧化还原反应又属于置换反应的是( )
A.CuO+H2![]() Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2O
Cu+H2OB.CO2+Ca(OH)2=CaCO3↓+H2O
C.Fe2O3+3CO![]() 2Fe+3CO2D.2Na2O2+2H2O=4NaOH+O2↑
2Fe+3CO2D.2Na2O2+2H2O=4NaOH+O2↑
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O![]() HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
HS-+OH,在溶液中加入少量CuSO4固体,HS-浓度减小。下列说法正确的是
A. 稀释溶液,水解平衡常数增大
B. Ksp(CuS)<Ksp[Cu(OH)2]
C. 升高温度![]() 增大
增大
D. 加入MgCl2固体,HS-浓度减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课外小组的同学通过实验探究认识化学反应速率和化学反应限度。
(1)实验一:探究温度和浓度对反应速率的影响
实验原理及方案:在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生反应生成碘,反应原理是2IO3-+5SO32-+2H+===I2+5SO42-+H2O,生成的碘可用淀粉溶液检验,根据出现蓝色所需的时间来衡量该反应的速率。
实验序号 | 0.01 mol·L-1 KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1 Na2SO3溶液的体积/mL | 水的体积/mL | 实验温度/℃ | 出现蓝色的时间/s |
① | 5 | 5 | V1 | 0 | |
② | 5 | 5 | 40 | 25 | |
③ | 5 | V2 | 35 | 25 |
则V1=________ mL,V2=________ mL。
(2)实验二:探究KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度。实验步骤:
ⅰ.向5 mL 0.1 mol·L-1 KI溶液中滴加5~6滴0.1 mol·L-1 FeCl3溶液,充分反应后,将所得溶液分成甲、乙、丙三等份;
ⅱ.向甲中滴加CCl4,充分振荡;
ⅲ.向乙中滴加试剂X。
①将KI和FeCl3反应的离子方程式补充完整:____I-+____Fe3+ ![]() ____I2+____Fe2+。
____I2+____Fe2+。
②步骤ⅲ中,试剂X是_________________。
③步骤ⅱ和ⅲ中的实验现象说明KI和FeCl3混合时生成KCl、I2和FeCl2的反应存在一定的限度,该实验现象是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X位于第四周期,其基态原子有4个未成对电子。Y原子最外层电子数是其内层电子总数的3倍,元素Z基态原子的3p轨道上有4个电子。
(1)Y与Z可形成多种化合物。
① 元素Y与Z中电负性较大的是________(用元素符号描述)。
② 离子ZY32-的空间构型为________(用文字描述)。
③ 写出一种与ZY2互为等电子体的分子的化学式:________。
(2)Y的氢化物(H2Y)在乙醇中的溶解度大于H2Z,其原因是________。
(3)含X2+的溶液与KCN、氨水反应可得到化合物K3[X(CN)5(NH3)]。1 mol配合物K3[X(CN)5(NH3)]中含σ键的数目为______。
(4)下图为X与Z所形成的一种化合物的基本结构单元,推测该化合物的化学式为______。
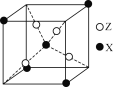
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验。
Ⅰ.(1)将钠、钾、镁、铝各1 mol分别投入到足量的同浓度的盐酸中,试预测实验结果:_____与盐酸反应最剧烈,____与盐酸反应产生的气体最多。
(2)向Na2S溶液中通入氯气出现黄色浑浊,可证明非金属性:Cl____S(填“>”或“<”),反应的离子方程式为_______。
Ⅱ.利用如图装置可验证同主族元素非金属性的变化规律。

(3)仪器A的名称为___________,干燥管D的作用为___________________。
(4)若要证明非金属性:Cl>I,C中为淀粉—碘化钾混合溶液,B中装有KMnO4固体,则A中试剂为___________,观察到C中溶液____________(填现象),即可证明。从环境保护的观点考虑,此装置缺少尾气处理装置,可用_________溶液吸收尾气。
(5)若要证明非金属性:C>Si,则在A中加盐酸、B中加CaCO3、C中加Na2SiO3溶液。观察到C中溶液 ________(填现象),即可证明。但有的同学认为盐酸具有挥发性,HCl可进入C中干扰实验,应在两装置间添加装有 _________溶液的洗气瓶除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用石油裂化和裂解得到的乙烯、丙烯合成丙烯酸乙酯的路线如图所示:
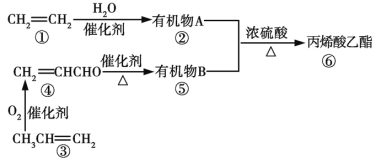
已知:—CHO![]() —COOH
—COOH
下列判断正确的是
A. 生成有机物⑥的原子利用率为100%
B. 有机物①②③④⑤⑥在一定条件下均可发生加聚反应
C. 丙烯酸乙酯在稀硫酸中不能发生水解反应
D. 有机物③④在一定条件下发生加聚反应可得![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钠(NaCN)是一种基本化工原料,同时也是一种毒物质。一旦泄漏需要及时处理,一般可以通过喷酒双氧水或过硫酸钠(Na2S2)溶液来处理,以减少对环境的污染。
I.(1)NaCN用双氧水处理后,产生一种酸式盐和一种能使湿润的红色石蕊试纸变蓝的气体,该反应的化学方程式是___________________________________。
II.工业制备过硫酸钠的反应原理如下所示
主反应:(NH4)2S2O8+2NaOH![]() Na2S2O8+2NH3↑+2H2O
Na2S2O8+2NH3↑+2H2O
副反应:2NH3+3Na2S2O8+6NaOH![]() 6Na2SO4+N2+6H2O
6Na2SO4+N2+6H2O
某化学小组利用上述原理在实验室制备过硫酸,并用过硫酸钠溶液处理含氰化钠的废水。
实验一:实验室通过如下图所示装置制备Na2S2O8。
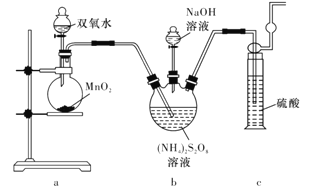
(2)装置中盛放(NH4)2S2O8溶液的仪器的名称是____________。
(3)装置a中反应产生的气体需要持续通入装置c的原因是____________________。
(4)上述装置中还需补充的实验仪器或装置有______________(填字母代号)。
A.温度计 B水浴加热装置
C.洗气瓶 D.环形玻璃搅拌棒
实验二:测定用过硫酸钠溶液处理后的废水中氯化钠的含量。
已知;①废水中氯化钠的最高排放标准为0.50mg/L。
②Ag++2CN—===[Ag(CN)2]—,Ag++I—==AgI↓,AgI呈黄色,CN—优先与Ag+发生反应。实验如下:取1L处理后的NaCN废水,浓缩为10.00mL置于锥形瓶中,并滴加几滴KI溶液作指示剂,用1.0![]() 10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
10—3mol/L的标准AgNO3溶液滴定,消耗AgNO3溶液的体积为5.00mL
(5)滴定终点的现象是___________________________________。
(6)处理后的废水中氰化钠的浓度为____________________mg/L.
Ⅲ.(7)常温下,含硫微粒的主要存在形式受pH的影响。利用电化学原理,用惰性电极电解饱和NaHSO4溶液也可以制备过硫酸钠。已知在阳极放电的离子主要为HSO4—,则阳极主要的反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象及结论均正确的是
实验操作、现象 | 结论 | |
A | 取1 mL 20%的蔗糖溶液,加入3~5滴稀硫酸。水浴加热5 min后取少量溶液,加入少量新制Cu(OH)2,加热,无砖红色沉淀产生 | 蔗糖没有发生水解 |
B | 向装有溴水的分液漏斗中加入裂化汽油,充分振荡并静置,下层为橙色 | 裂化汽油可以萃取溴 |
C | 将SO2通入紫色石蕊溶液中,溶液先变红后褪色 | SO2是酸性氧化物,还具有漂白性 |
D | 分别向盛有KI3溶液的a、b试管中滴加淀粉溶液、AgNO3溶液,a中溶液变蓝,b中产生黄色沉淀 | 溶液中存在:I3- |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com