
【题目】苯乙酸铜是合成优良催化剂、传感材料——纳米氧化铜的重要前驱体之一。下面是它的一种实验室合成路线:

制备苯乙酸的装置示意图如下(加热和夹持装置等略):

已知:苯乙酸的熔点为76.5 ℃,微溶于冷水,溶于乙醇。
回答下列问题:
(1)在250 mL三口瓶a中加入70 mL70%硫酸。配制此硫酸时,加入蒸馏水与浓硫酸的先后顺序是 。
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是 ;仪器c的名称是 ,其作用是 。
反应结束后加适量冷水,再分离出苯乙酸粗品。加人冷水的目的是 。下列仪器中可用于分离苯乙酸粗品的是 (填标号)。
A.分液漏斗 B.漏斗 C.烧杯 D.直形冷凝管 E.玻璃棒
(3)提纯粗苯乙酸的方法是 ,最终得到44 g纯品,则苯乙酸的产率是 。
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,判断沉淀洗干净的实验操作和现象是 。
(5)将苯乙酸加人到乙醇与水的混合溶剂中,充分溶解后,加入Cu(OH)2搅拌30min,过滤,滤液静置一段时间,析出苯乙酸铜晶体,混合溶剂中乙醇的作用是 。
【答案】(1)先加水,再加浓硫酸;(2)滴加苯乙腈;球形冷凝管;回流(或使汽化的反应液冷凝);便于苯乙酸析出;BCE(3)重结晶;95%;(4)取少量的洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现;(5)增大苯乙酸的溶解度,便于充分反应。
【解析】
试题分析:(1)稀释浓硫酸时,由于浓硫酸溶于水放出大量的热,容易造成液体飞溅,因此必须将浓硫酸加入水中,故应该先加入蒸馏水,再加浓硫酸;
(2)将a中的溶液加热至100 ℃,缓缓滴加40 g苯乙腈到硫酸溶液中,然后升温至130 ℃继续反应。在装置中,仪器b的作用是滴加苯乙腈;仪器c是球形冷凝管,作用是使汽化的反应液冷凝回流;反应结束后,加适量的冷水,降低温度,减小苯乙酸的溶解度,则加入冷水便于苯乙酸析出;分离苯乙酸粗品的操作是过滤,需要用到的仪器有漏斗、烧杯和玻璃棒,故答案BCE;
(3)由于苯乙酸微溶于冷水,在冷水中的溶解度较小,因此提纯粗苯乙酸的方法是重结晶;由反应![]() 可知,40g苯乙腈生成苯乙酸的质量为:
可知,40g苯乙腈生成苯乙酸的质量为:![]() ,最终得到44g纯品,因此产率为:
,最终得到44g纯品,因此产率为:![]() ;
;
(4)用CuCl2 2H2O和NaOH溶液制备适量Cu(OH)2沉淀,并多次用蒸馏水洗涤沉淀,若沉淀未洗干净,则沉淀中含有氯离子,因此判断沉淀洗干净,则要证明沉淀中不含有氯离子,实验操作和现象是:取少量的洗涤液,加入稀硝酸,再加入AgNO3溶液,无白色浑浊出现;
(5)苯乙酸微溶于冷水,易溶于乙醇,混合溶剂中乙醇可以增大苯乙酸的溶解度,然后与将Cu(OH)2反应除去苯乙酸,析出苯乙酸铜晶体,即混合溶剂中乙醇的作用是增大苯乙酸的溶解度,便于充分反应。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案科目:高中化学 来源: 题型:
【题目】有X、Y、Z、T、U五种短周期元素。X、Y、Z三元素在周期表中的位置如下所示,三元素的原子序数之和是41。X和T的单质在不同条件下反应,可以生成T2X(白色固体)和T2X2(淡黄色固体)两种化合物。U单质在Z单质中燃烧时产生苍白色火焰,生成物的水溶液能使石蕊试液变红。
X | |
Y | Z |
(1)各元素的符号是:Z________,T________
(2)Y原子的结构示意图为____________________,U2X的电子式
(3)YX2和U2Y反应的化学方程式为____________________________,其中氧化剂是____________,被氧化的元素是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol![]() NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取l0mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少升?(保留两位有效数字。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色。实验流程如下:

请回答:
(1)步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
(3)烘干时,温度控制在80℃为宜,理由是 。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极。请写出阳极的电极反应式 ,与原方法相比,电解法的优势为 。
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①量取KMnO4溶液应选用 (填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将 (填“偏大”、“偏小”或“不变”)。
②滴定过程中反应的离子方程式为______。(已知:常温下0.01 mol/L的H2C2O4溶液的pH为2.1)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
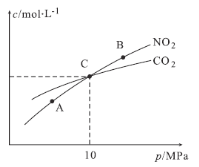
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+ 4CO(g)![]() CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。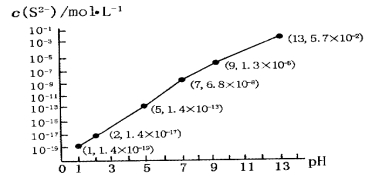
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiCIO4。溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。

回答下列问题:
(1)外电路的电流方向是由____极流向____极。(填字母)
(2)电池正极反应式为__ __。
(3)是否可用水代替电池中的混合有机溶剂?____(填“是”或“否”),原因是_________ ___。
(4)MnO2可与KOH和KClO3,在高温下反应,生成K2MnO4,反应的化学方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。请回答下列问题:

(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式___________________________。
(3)元素第一电离能为⑤____________⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有___________对弧对电子,其VSEPR模型为_________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:

(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ _____________ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制取SO2的反应原理为:Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。请用下列装置设计一个实验,以测定SO2转化为SO3的转化率:

(1)这些装置的连接顺序(按气体左右的方向)是 → → → →
→ → → (填各接口的编号)。
(2)实验时甲仪器橡胶支管的作用与原理是 。
(3)从乙处均匀通入O2,为使SO2有较高的转化率,实验时Ⅰ处滴入浓硫酸与Ⅱ处加热催化剂的先后顺序是 。
(4)Ⅳ处观察到的现象是 。
(5)在Ⅰ处用大火加热烧瓶时,SO2的转化率会 (填“增大”“不变”或“减小”)。
(6)用n mol Na2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,称得Ⅲ处增重m g,则本实验中SO2的转化率为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com