
”¾ĢāÄæ”æµŖŗĶĮņµÄ»ÆŗĻĪļŌŚ¹¤Å©ŅµÉś²ś”¢Éś»īÖŠ¾ßÓŠÖŲŅŖÓ¦ÓĆ”£Ēė»Ų“šĻĀĮŠĪŹĢā£ŗ
(1)ŗ½ĢģĮģÓņÖŠ³£ÓĆN2H4×÷ĪŖ»š¼ż·¢ÉäµÄÖśČ¼¼Į”£N2H4Óė°±ĘųĻąĖĘ£¬ŹĒŅ»ÖÖ¼īŠŌĘųĢ壬Ņ×ČÜÓŚĖ®£¬Éś³ÉČõ¼īN2H4”¤H2O”£ÓƵēĄė·½³ĢŹ½±ķŹ¾N2H4”¤H2OĻŌ¼īŠŌµÄŌŅņ ”£
£Ø2£©ŌŚŗćĪĀĢõ¼žĻĀ£¬1 mol NO2ŗĶ×ćĮæC·¢Éś·“Ó¦:2NO2(g)+2C(s)![]() N2(g)+2CO2(g)£¬²āµĆĘ½ŗāŹ±NO2ŗĶCO2µÄĪļÖŹµÄĮæÅضČÓėĘ½ŗā×ÜŃ¹µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
N2(g)+2CO2(g)£¬²āµĆĘ½ŗāŹ±NO2ŗĶCO2µÄĪļÖŹµÄĮæÅضČÓėĘ½ŗā×ÜŃ¹µÄ¹ŲĻµČēĶ¼ĖłŹ¾£ŗ
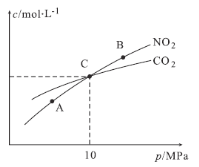
¢ŁA”¢BĮ½µćµÄÅضČĘ½ŗā³£Źż¹ŲĻµ£ŗKc(A) Kc(B)£ØĢī”°£¼”±»ņ”°£¾”±»ņ”°=”±£©”£
¢ŚA”¢B”¢CČżµćÖŠNO2µÄ×Ŗ»ÆĀŹ×īøߵďĒ £ØĢī”°A”±»ņ”°B”±»ņ”°C”±£©µć”£
¢Ū¼ĘĖćCµćŹ±øĆ·“Ó¦µÄŃ¹ĒæĘ½ŗā³£ŹżKp= £ØĮŠ³ö±ķ“ļŹ½²¢¼ĘĖć½į¹ū”£KpŹĒÓĆĘ½ŗā·ÖŃ¹“śĢęĘ½ŗāÅØ¶Č¼ĘĖć£¬·ÖŃ¹£½×ÜŃ¹”ĮĪļÖŹµÄĮæ·ÖŹż£©”£
£Ø3£©ŃĒĻõĖįµÄµēĄėĘ½ŗā³£ŹżKa=5.1”Į10-4£Ø298K£©”£ĖüµÄŠŌÖŹŗĶĻõĖįŗÜĄąĖĘ”£
¢ŁŅŃÖŖ298K Ź±£¬H2COµÄKa1=4.2”Į10-7 £»Ka2=5.61”Į10-11”£Ļņŗ¬ÓŠ2molĢ¼ĖįÄʵÄČÜŅŗÖŠ¼ÓČė1molµÄHNO2ŗó£¬ŌņČÜŅŗÖŠCO32-”¢HCO3-ŗĶNO2-µÄĄė×ÓÅضČÓɓ󵽊”ŹĒ ”£
¢Ś½«10mL0.1mol/LµÄŃĒĻõĖįČÜŅŗ¼ÓČėµ½10mL0.1mol/L°±Ė®£ØŅŃÖŖŌŚ25”ꏱ£¬Ņ»Ė®ŗĻ°±µÄKi= 1.8”Į10-5£©ÖŠ,×īŗóĖłµĆČÜŅŗĪŖ________£ØĢī”°ĖįŠŌ”±”¢”°¼īŠŌ”±»ņÕß”°ÖŠŠŌ”±£©”£
£Ø4£©Ņ»ÖÖĆŗĢæĶŃĮņ¼¼ŹõæÉŅŌ°ŃĮņŌŖĖŲŅŌCaSO4µÄŠĪ³É¹Ģ¶ØĻĀĄ“£¬µ«²śÉśµÄCOÓÖ»įÓėCaSO4·¢Éś»Æѧ·“Ó¦£¬Ļą¹ŲµÄČČ»Æѧ·½³ĢŹ½ČēĻĀ£ŗ
¢ŁCaSO4£Øs£©+CO£Øg£©![]() CaO£Øs£©+SO2£Øg£©+CO2£Øg£©”÷H = +210.5kJmol-1
CaO£Øs£©+SO2£Øg£©+CO2£Øg£©”÷H = +210.5kJmol-1
¢ŚCaSO4£Øs£©+ 4CO£Øg£©![]() CaS£Øs£©+ 4CO2£Øg£© ”÷H = -189.2kJmol-1
CaS£Øs£©+ 4CO2£Øg£© ”÷H = -189.2kJmol-1
·“Ó¦CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) ”÷H= kJmol-1£»
CaS(s)+3CO2(g) ”÷H= kJmol-1£»
(5)H2SĘųĢåČÜÓŚĖ®ŠĪ³ÉµÄĒāĮņĖįŹĒŅ»ÖÖ¶žŌŖČõĖį£¬25”ꏱ£¬ŌŚ0.10 mol”¤L-1H2SČÜŅŗÖŠ£¬ĶØČĖHClĘųĢå»ņ¼ÓČėNaOH¹ĢĢåŅŌµ÷½ŚČÜŅŗpH£¬ČÜŅŗpHÓėc(S2-)¹ŲĻµČēĶ¼ĖłŹ¾(ŗöĀŌČÜŅŗĢå»żµÄ±ä»Æ”¢H2SµÄ»Ó·¢)”£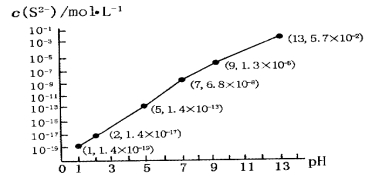
¢ŁpH=13Ź±£¬ČÜŅŗÖŠµÄc(H2S)+c(HS-)=__________mol”¤L-1£»
¢ŚÄ³ČÜŅŗŗ¬0.010 mol”¤L-1Fe2+ŗĶ0.10 mol”¤L-1H2S£¬µ±ČÜŅŗpH=______Ź±£¬Fe2+æŖŹ¼³Įµķ”£”¾ŅŃÖŖ£ŗKSP(FeS)=1.4”Į10-19”æ
”¾“š°ø”æ£Ø1£©N2H4”¤H2O![]() N2H5++OH-£Ø»ņN2H4+H2O
N2H5++OH-£Ø»ņN2H4+H2O![]() N2H5++OH-£©£Ø2£©¢Ł=¢ŚA
N2H5++OH-£©£Ø2£©¢Ł=¢ŚA
¢Ū2 MPa£Ø3£©[HCO3-]£¾[NO2-]£¾[CO32-] £Ø2£©ĖįŠŌ£Ø4£©-399.7 £Ø5£©¢Ł0.043 ¢Ś2
”¾½āĪö”æ
ŹŌĢā·ÖĪö£ŗ£Ø1£©øĆ»ÆŗĻĪļµÄŠŌÖŹÓė°±ĘųĄąĖĘ£¬ĖµĆ÷ÄܵēĄė³öĒāŃõøłĄė×Ó¶ųĻŌ¼īŠŌ£¬Ņņ“ĖČÜŅŗĻŌ¼īŠŌµÄĄė×Ó·½³ĢŹ½ĪŖN2H4”¤H2O![]() N2H5++OH-”£
N2H5++OH-ӣ
£Ø2£©¢ŁA”¢BĮ½µćµÄĪĀ¶ČĻąĶ¬£¬ŌņĘ½ŗā³£Źż¹ŲĻµŹĒKc(A£½Kc(B)”£
¢ŚÕż·“Ó¦ŹĒĢå»żŌö“óµÄæÉÄę·“Ó¦£¬Ń¹ĒæŌ½“ó£¬Ō½²»ĄūÓŚNO2µÄ×Ŗ»Æ£¬ĖłŅŌA”¢B”¢CČżµćÖŠNO2µÄ×Ŗ»ÆĀŹ×īøߵďĒAµć”£
¢Ū 2NO2(g)+2C(s)![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
ĘšŹ¼Įæ£Ømol£© 1 0 0
×Ŗ»ÆĮæ£Ømol£© 2x x 2x
Ę½ŗāĮæ£Ømol£© 1-2x x 2x
CµćCO2ŗĶNO2µÄÅضČĻąµČ£¬Ōņ1£2x£½2x£¬½āµĆx£½0.25£¬Ōņ“ĖŹ±»ģŗĻĘųĢåµÄ×ÜĪļÖŹµÄĮæŹĒ1£«x£½1.25£¬ĖłŅŌCµćŹ±øĆ·“Ó¦µÄŃ¹ĒæĘ½ŗā³£ŹżKp£½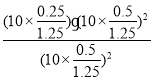 £½2MPa”£
£½2MPa”£
£Ø3£©¢ŁÓÉŃĒĻõĖįµÄµēĄėĘ½ŗā³£ŹżKa=5.1”Į10-4£¬H2COµÄKa1=4.2”Į10-7”¢Ka2=5.61”Į10-11æÉÅŠ¶ĻŃĒĻõĖįµÄĖįŠŌĒæÓŚĢ¼Ėį£¬Ņņ“ĖĻņŗ¬ÓŠ2molĢ¼ĖįÄʵÄČÜŅŗÖŠ¼ÓČė1molµÄHNO2ŗóÉś³É1molĢ¼ĖįĒāÄĘ”¢1molŃĒĻõĖįÄĘ£¬ĮķĶā»¹Ź£Óą1molĢ¼ĖįÄĘ£¬Ė®½ā³Ģ¶Č“óŠ”Ė³ŠņĪŖCO32-£¾NO2-£¬Ė®½āÉś³ÉHCO3-£¬ĖłŅŌČÜŅŗÖŠCO32-”¢HCO3-ŗĶNO2-Ąė×ÓµÄÅØ¶Č“óŠ”¹ŲĻµĪŖ[HCO3-]£¾[NO2-]£¾[CO32-]£»
¢ŚŅŃÖŖŌŚ25”ꏱ£¬Ņ»Ė®ŗĻ°±µÄKi=1.8”Į10-5£¬ŃĒĻõĖįµÄµēĄėĘ½ŗā³£ŹżKa=5.1”Į10-4£¬ĖłŅŌŃĒĻõĖįµÄµēĄė³Ģ¶Č“óÓŚŅ»Ė®ŗĻ°±µÄµēĄė³Ģ¶Č£¬Ōņļ§øłĄė×ÓµÄĖ®½ā³Ģ¶Č“óÓŚŃĒĻõĖįøłĄė×ӵijĢ¶Č£¬øł¾ŻŌ½ČõŌ½Ė®½ā£¬ļ§øłĄė×ÓµÄĖ®½ā³Ģ¶Č“ó£¬ĖłŅŌ×īŗóĖłµĆČÜŅŗĪŖĖįŠŌ£»
£Ø4£©ŅŃÖŖ¢ŁCaSO4£Øs£©+CO£Øg£©![]() CaO£Øs£©+SO2£Øg£©+CO2£Øg£©”÷H = +210.5kJmol-1
CaO£Øs£©+SO2£Øg£©+CO2£Øg£©”÷H = +210.5kJmol-1
¢ŚCaSO4£Øs£©+ 4CO£Øg£©![]() CaS£Øs£©+ 4CO2£Øg£© ”÷H = -189.2kJmol-1
CaS£Øs£©+ 4CO2£Øg£© ”÷H = -189.2kJmol-1
Ōņøł¾ŻøĒĖ¹¶ØĀÉæÉÖŖ¢Ś£¢Ł¼“µĆµ½·“Ó¦CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g)µÄ·“Ó¦ČČ”÷H£½-399.7kJmol-1£»
CaS(s)+3CO2(g)µÄ·“Ó¦ČČ”÷H£½-399.7kJmol-1£»
£Ø5£©¢Łøł¾ŻČÜŅŗpHÓėc£ØS2-£©¹ŲĻµĶ¼pH=13Ź±£¬c£ØS2-£©£½5.7”Į10-2mol/L£¬ŌŚ0.10molL-1H2SČÜŅŗÖŠøł¾ŻĮņŹŲŗćc£ØH2S£©+c£ØHS-£©+c£ØS2-£©£½0.10molL-1£¬ĖłŅŌc£ØH2S£©+c£ØHS-£©£½0.1-5.7”Į10-2£½0.043mol/L£»
¢Śµ±Qc=Ksp£ØFeS£©Ź±æŖŹ¼³Įµķ£¬ĖłŅŌc£ØS2-£©£½Ksp(FeS)”Āc(Fe2+)£½1.4”Į1019mol/L£¬½įŗĻĶ¼ĻóµĆ³ö“ĖŹ±µÄpH=2£¬ĖłŅŌpH=2Ź±ŃĒĢśĄė×ÓæŖŹ¼³Įµķ”£


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĶس£°Ń²šæŖ1 molij»Æѧ¼üĖłĪüŹÕµÄÄÜĮæ擳ÉøĆ»Æѧ¼üµÄ¼üÄÜ£®ŅŃÖŖ²æ·Ö»Æѧ¼üµÄ¼üÄÜČēĻĀ£ŗ
»Æѧ¼ü | N”ŖH | N”ŖN | O=O | N”ŌN | O”ŖH |
¼üÄÜ(kJ”¤mol£1) | 386 | 167 | 498 | 946 | 460 |
£Ø1£©·¢ÉäÉńÖŪ·É“¬µÄ³¤Õ÷»š¼żÓĆĮĖėĀ(N2H4£¬ĘųĢ¬)ĪŖČ¼ĮĻ£¬ČōĖüŌŚŃõĘų(ĘųĢ¬)ÖŠČ¼ÉÕ£¬Éś³ÉN2(ĘųĢ¬)ŗĶH2O(ŅŗĢ¬)”£1 molėĀĶźČ«Č¼ÉÕŹ±·Å³öµÄČČĮæĪŖ________”£
£Ø2£©ėĀ-æÕĘųČ¼ĮĻµē³ŲŹĒŅ»ÖÖ¼īŠŌČ¼ĮĻµē³Ų£¬µē½āÖŹČÜŅŗŹĒ20%”«30%µÄKOH ČÜŅŗ”£ėĀ-æÕĘųČ¼ĮĻµē³Ų·ÅµēŹ±£¬Õż¼«µÄµē¼«·“Ó¦Ź½ŹĒ______________________________________”£
£Ø3£©ŅŃÖŖN60·Ö×ÓÖŠĆæøöNŌ×Ó¾łŅŌµŖµŖ¼ü½įŗĻČżøöµŖŌ×Ó£¬ĒŅN60·Ö×Ó½į¹¹ÖŠĆæøöµŖŌ×Ó¾łŠĪ³É8øöµē×ÓµÄĪČ¶Ø½į¹¹”£ŹŌĶĘ²ā1øöN60µÄ½į¹¹ŗ¬ÓŠ________øöN”ŖN¼ü”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĢ¼”¢µŖ”¢ĮņŹĒ֊ѧ»ÆѧÖŲŅŖµÄ·Ē½šŹōŌŖĖŲ£¬ŌŚ¹¤Å©ŅµÉś²śÖŠÓŠ¹ć·ŗµÄÓ¦ÓĆ”£
£Ø1£©ÓĆÓŚ·¢Éä”°Ģģ¹¬Ņ»ŗÅ”±µÄ³¤Õ÷¶žŗÅ»š¼żµÄČ¼ĮĻŹĒŅŗĢ¬Ę«¶ž¼×ėĀ£ØCH3£©2N£NH2£¬Ńõ»Æ¼ĮŹĒŅŗĢ¬ĖÄŃõ»Æ¶žµŖ”£¶žÕßŌŚ·“Ó¦¹ż³ĢÖŠ·Å³ö“óĮæÄÜĮ棬Ķ¬Ź±Éś³ÉĪŽ¶¾”¢ĪŽĪŪČ¾µÄĘųĢ唣ŅŃÖŖŹŅĪĀĻĀ£¬1 gČ¼ĮĻĶźČ«Č¼ÉÕŹĶ·Å³öµÄÄÜĮæĪŖ42.5kJ£¬ĒėŠ“³öøĆ·“Ó¦µÄČČ»Æѧ·½³ĢŹ½ ”£
£Ø2£©298 KŹ±£¬ŌŚ2LµÄĆܱÕČŻĘ÷ÖŠ£¬·¢ÉśæÉÄę·“Ó¦£ŗ2NO2(g)![]() N2O4(g) ¦¤H£½£a kJ”¤mol£1 (a£¾0) ”£N2O4µÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆČēĶ¼”£“ļĘ½ŗāŹ±£¬N2O4µÄÅضČĪŖNO2µÄ2±¶£¬»Ų“šĻĀĮŠĪŹĢā”£
N2O4(g) ¦¤H£½£a kJ”¤mol£1 (a£¾0) ”£N2O4µÄĪļÖŹµÄĮæÅضČĖꏱ¼ä±ä»ÆČēĶ¼”£“ļĘ½ŗāŹ±£¬N2O4µÄÅضČĪŖNO2µÄ2±¶£¬»Ų“šĻĀĮŠĪŹĢā”£

¢Ł298KŹ±£¬øĆ·“Ó¦µÄĘ½ŗā³£ŹżĪŖ________”£
¢ŚŌŚĪĀ¶ČĪŖT1”¢T2Ź±£¬Ę½ŗāĢåĻµÖŠNO2µÄĢå»ż·ÖŹżĖęŃ¹Ēæ±ä»ÆĒśĻßČēĶ¼ĖłŹ¾”£ĻĀĮŠĖµ·ØÕżČ·µÄŹĒ ”£

a£®A”¢CĮ½µćµÄ·“Ó¦ĖŁĀŹ£ŗA£¾C
b£®B”¢CĮ½µćµÄĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ£ŗB£¼C
c£®A”¢CĮ½µćĘųĢåµÄŃÕÉ«£ŗAÉī£¬CĒ³
d£®ÓÉדĢ¬Bµ½×“Ģ¬A£¬æÉŅŌÓĆ¼ÓČȵķ½·Ø
¢ŪČō·“Ó¦ŌŚ398K½ųŠŠ£¬Ä³Ź±æĢ²āµĆn£ØNO2£©=0.6 mol ”¢n£ØN2O4£©=1.2mol£¬
Ōņ“ĖŹ±V£ØÕż£© V£ØÄę£©£ØĢī”°>”±”¢”°<”±»ņ”°=”±£©”£
 £Ø3£©NH4HSO4ŌŚ·ÖĪöŹŌ¼Į”¢Ņ½Ņ©”¢µē×Ó¹¤ŅµÖŠÓĆĶ¾¹ć·ŗ”£ĻÖĻņ100 mL 0.1 mol”¤L£1NH4HSO4ČÜŅŗÖŠµĪ¼Ó0.1 mol”¤L£1NaOHČÜŅŗ£¬µĆµ½µÄČÜŅŗpHÓėNaOHČÜŅŗĢå»żµÄ¹ŲĻµĒśĻßČēĶ¼ĖłŹ¾”£ŹŌ·ÖĪöĶ¼ÖŠa”¢b”¢c”¢d”¢eĪåøöµć£¬
£Ø3£©NH4HSO4ŌŚ·ÖĪöŹŌ¼Į”¢Ņ½Ņ©”¢µē×Ó¹¤ŅµÖŠÓĆĶ¾¹ć·ŗ”£ĻÖĻņ100 mL 0.1 mol”¤L£1NH4HSO4ČÜŅŗÖŠµĪ¼Ó0.1 mol”¤L£1NaOHČÜŅŗ£¬µĆµ½µÄČÜŅŗpHÓėNaOHČÜŅŗĢå»żµÄ¹ŲĻµĒśĻßČēĶ¼ĖłŹ¾”£ŹŌ·ÖĪöĶ¼ÖŠa”¢b”¢c”¢d”¢eĪåøöµć£¬

¢ŁĖ®µÄµēĄė³Ģ¶Č×ī“óµÄŹĒ £»
¢ŚĘäČÜŅŗÖŠc(OH-)µÄŹżÖµ×ī½Ó½üNH3”¤H2OµÄµēĄė³£Źż
KŹżÖµµÄŹĒ £»
¢ŪŌŚcµć£¬ČÜŅŗÖŠø÷Ąė×ÓÅضČÓɓ󵽊”µÄÅÅĮŠĖ³ŠņŹĒ
ӣ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŅŃÖŖijæÉÄę·“Ó¦£ŗmA£Øg£©£«nB£Øg£©![]() r C£Øg£©ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ĻĀĶ¼±ķŹ¾“Ė·“Ó¦ŌŚ²»Ķ¬Ź±¼ät£¬ĪĀ¶ČTŗĶŃ¹ĒæpÓė·“Ó¦ĪļBŌŚ»ģŗĻĘųĢåÖŠµÄ°Ł·Öŗ¬Įæ£ØB%£©µÄ¹ŲĻµĒśĻß”£ÓÉĒśĻß·ÖĪöĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ
r C£Øg£©ŌŚĆܱÕČŻĘ÷ÖŠ½ųŠŠ”£ĻĀĶ¼±ķŹ¾“Ė·“Ó¦ŌŚ²»Ķ¬Ź±¼ät£¬ĪĀ¶ČTŗĶŃ¹ĒæpÓė·“Ó¦ĪļBŌŚ»ģŗĻĘųĢåÖŠµÄ°Ł·Öŗ¬Įæ£ØB%£©µÄ¹ŲĻµĒśĻß”£ÓÉĒśĻß·ÖĪöĻĀĮŠÅŠ¶ĻÕżČ·µÄŹĒ

A. T1£¾T2£¬p1£¾p2£¬m£«n£¾r£¬Õż·“Ó¦ĪüČČ
B. T1£¼T2£¬p1£¼p2£¬m£«n£¼r£¬Õż·“Ó¦ĪüČČ
C. T1£¾T2£¬p1£¾p2£¬m£«n£¼r£¬Õż·“Ó¦·ÅČČ
D. T1£¼T2£¬p1£¼p2£¬m£«n£¾r£¬Õż·“Ó¦·ÅČČ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æQ”¢W”¢X”¢Y”¢ZŹĒŌ×ÓŠņŹżŅĄ“ĪŌö“óµÄ¶ĢÖÜĘŚŌŖĖŲ£¬X”¢YŹĒ½šŹōŌŖĖŲ£¬Q”¢W”¢ZŹĒ·Ē½šŹōŌŖĖŲ”£XŹĒĶ¬ÖÜĘŚÖŠ½šŹōŠŌ×īĒæµÄŌŖĖŲ£¬ĪåÖÖŌŖĖŲŗĖµēŗÉŹżÖ®ŗĶĪŖ55£¬¶ŌÓ¦Ō×Ó×īĶā²ćµē×ÓŹżÖ®ŗĶĪŖ21”£W”¢Z×īĶā²ćµē×ÓŹżĻąĶ¬£¬µ«ZµÄŗĖµēŗÉŹżŹĒWµÄ2±¶”£
£Ø1£©QŌŚÖÜĘŚ±ķÖŠĪ»ÖĆŹĒ ”£
£Ø2£©X”¢Yø÷×ŌµÄ×īøß¼ŪŃõ»ÆĪļ¶ŌÓ¦µÄĖ®»ÆĪļæÉŅŌ·¢Éś·“Ӧɜ³ÉŃĪŗĶĖ®£¬ĒėŠ“³öøĆ·“Ó¦µÄĄė×Ó·½³ĢŹ½£ŗ ”£
£Ø3£©Xµ„ÖŹÄÜŌŚWµ„ÖŹÖŠČ¼ÉÕæÉÉś³É»ÆŗĻĪļR£¬RµÄµē×ÓŹ½ ___£¬øĆĪļÖŹĖłŗ¬ÓŠµÄĪ¢Į£¼ä×÷ÓĆĮ¦µÄĄąŠĶĪŖ ”£
£Ø4£©ZµÄĒā»ÆĪļÓėWµÄŅ»ÖÖĒā»ÆĪļ·¢Éś·“Ó¦æÉÉś³ÉZµÄµ„ÖŹ£¬Š“³öĘä»Æѧ·½³ĢŹ½ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æ±½ŅŅĖįĶŹĒŗĻ³ÉÓÅĮ¼“߻ƼĮ”¢“«øŠ²ÄĮĻ”Ŗ”ŖÄÉĆ×Ńõ»ÆĶµÄÖŲŅŖĒ°ĒżĢåÖ®Ņ»”£ĻĀĆęŹĒĖüµÄŅ»ÖÖŹµŃéŹŅŗĻ³ÉĀ·Ļߣŗ

Öʱø±½ŅŅĖįµÄ×°ÖĆŹ¾ŅāĶ¼ČēĻĀ(¼ÓČČŗĶ¼Š³Ö×°ÖƵČĀŌ)£ŗ

ŅŃÖŖ£ŗ±½ŅŅĖįµÄČŪµćĪŖ76.5 ”ę£¬Ī¢ČÜÓŚĄäĖ®£¬ČÜÓŚŅŅ“¼”£
»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©ŌŚ250 mLČżæŚĘæaÖŠ¼ÓČė70 mL70%ĮņĖį”£ÅäÖĘ“ĖĮņĖįŹ±£¬¼ÓČėÕōĮóĖ®ÓėÅØĮņĖįµÄĻČŗóĖ³ŠņŹĒ ”£
£Ø2£©½«aÖŠµÄČÜŅŗ¼ÓČČÖĮ100 ”ę£¬»ŗ»ŗµĪ¼Ó40 g±½ŅŅėęµ½ĮņĖįČÜŅŗÖŠ£¬Č»ŗóÉżĪĀÖĮ130 ”ę¼ĢŠų·“Ó¦”£ŌŚ×°ÖĆÖŠ£¬ŅĒĘ÷bµÄ×÷ÓĆŹĒ £»ŅĒĘ÷cµÄĆū³ĘŹĒ £¬Ęä×÷ÓĆŹĒ ”£
·“Ó¦½įŹųŗó¼ÓŹŹĮæĄäĖ®£¬ŌŁ·ÖĄė³ö±½ŅŅĖį“ÖĘ·”£¼ÓČĖĄäĖ®µÄÄæµÄŹĒ ”£ĻĀĮŠŅĒĘ÷ÖŠæÉÓĆÓŚ·ÖĄė±½ŅŅĖį“ÖĘ·µÄŹĒ (Ģī±źŗÅ)”£
A£®·ÖŅŗĀ©¶· B£®Ā©¶· C£®ÉÕ± D£®Ö±ŠĪĄäÄż¹Ü E£®²£Į§°ō
£Ø3£©Ģį“æ“Ö±½ŅŅĖįµÄ·½·ØŹĒ £¬×īÖÕµĆµ½44 g“æĘ·£¬Ōņ±½ŅŅĖįµÄ²śĀŹŹĒ ”£
£Ø4£©ÓĆCuCl2 2H2OŗĶNaOHČÜŅŗÖʱøŹŹĮæCu(OH)2³Įµķ£¬²¢¶ą“ĪÓĆÕōĮóĖ®Ļ“µÓ³Įµķ£¬ÅŠ¶Ļ³ĮµķĻ“øɾ»µÄŹµŃé²Ł×÷ŗĶĻÖĻóŹĒ ”£
£Ø5£©½«±½ŅŅĖį¼ÓČĖµ½ŅŅ“¼ÓėĖ®µÄ»ģŗĻČܼĮÖŠ£¬³ä·ÖČܽāŗ󣬼ÓČėCu(OH)2½Į°č30min£¬¹żĀĖ£¬ĀĖŅŗ¾²ÖĆŅ»¶ĪŹ±¼ä£¬Īö³ö±½ŅŅĖįĶ¾§Ģ壬»ģŗĻČܼĮÖŠŅŅ“¼µÄ×÷ÓĆŹĒ ”£
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æŌŚ2LĆܱÕČŻĘ÷ÄŚ£¬800”ꏱ·“Ó¦£ŗ2NO(g)+O2(g)![]() 2NO2(g)ĢåĻµÖŠ£¬n(NO)Ėꏱ¼äµÄ±ä»ÆČēĻĀ±ķ£ŗ
2NO2(g)ĢåĻµÖŠ£¬n(NO)Ėꏱ¼äµÄ±ä»ÆČēĻĀ±ķ£ŗ
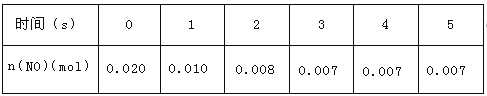
£Ø1£©ĻĀĶ¼±ķŹ¾NO2µÄ±ä»ÆĒśĻߏĒ_____”£ÓĆO2±ķŹ¾“Ó0-2sÄŚøĆ·“Ó¦µÄĘ½¾łĖŁĀŹv=____”£
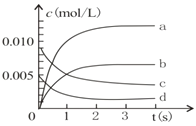
(2)ÄÜĖµĆ÷øĆ·“Ó¦¼ŗ“ļµ½Ę½ŗāדĢ¬µÄŹĒ_____£ØĢī×ÖÄøŠņŗÅ£¬ĻĀĶ¬£©”£
a£®v£ØNO2£©=2v£ØO2£©
b£®ČŻĘ÷ÄŚĘųĢå×ÜĪļÖŹµÄĮæ±£³Ö²»±ä
c£®VÄę£ØNO£©=2vÕż£ØO2 £©
d£®ČŻĘ÷ÄŚĘųĢåµÄĆܶȱ£³Ö²»±ä
£Ø3£©ĪŖŹ¹øĆ·“Ó¦µÄ·“Ó¦ĖŁĀŹŌö“ó£¬ĻĀĮŠ“ėŹ©ÕżČ·µÄŹĒ_____”£
A£®¼°Ź±·ÖĄė³öNO2ĘųĢå B£®ŹŹµ±ÉżøßĪĀ¶Č
C£®Ōö“óO2µÄÅØ¶Č D£®Ń”Ōńøߊ§“߻ƼĮ
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æĒāÄÜŹĒŅ»ÖÖ¼«¾ß·¢Õ¹Ē±Į¦µÄĒå½ąÄÜŌ“”£ŅŌĢ«ŃōÄÜĪŖČČŌ“£¬ČČ»ÆѧĮņµāŃ»··Ö½āĖ®ŹĒŅ»ÖÖøߊ§”¢ĪŽĪŪČ¾µÄÖĘĒā·½·Ø”£Ęä·“Ó¦¹ż³ĢČēĶ¼ĖłŹ¾£ŗ

£Ø1£©Š“³ö·“Ó¦I”¢IIµÄ»Æѧ·½³ĢŹ½£Ø²»±ŲŠ“·“Ó¦Ģõ¼ž£©£ŗ
I”¢ £»II £»III”¢2HI![]() H2£«I2
H2£«I2
£Ø2£©Õūøö¹ż³ĢÖŠĘšµ½ĮĖ“ß»Æ×÷ÓƵÄĪļÖŹŹĒ £ØŠ“»ÆѧŹ½£©”£
£Ø3£©Ņ»¶ØĪĀ¶ČĻĀ£¬Ļņ2LĆܱÕČŻĘ÷ÖŠ¼ÓČė1molHI£Øg£©£¬·¢Éś·“Ó¦III£¬Éś³ÉµÄI2ĪŖĘųĢ壬H2ĪļÖŹµÄĮæĖꏱ¼äµÄ±ä»ÆČēĶ¼ĖłŹ¾”£Ōņ0-2minÄŚµÄĘ½¾ł·“Ó¦ĖŁĀŹv£ØHI£©= £¬ÄÜ×÷ĪŖøĆ·“Ó¦“ļµ½Ę½ŗāדĢ¬ÅŠ¶ĻŅĄ¾ŻµÄŹĒ ”£
¢Łn£ØH2£©=n£ØI2£© ¢ŚŃ¹Ēæ²»ŌŁ±ä»Æ ¢ŪĘųĢåĆÜ¶Č²»ŌŁ±ä»Æ
¢Ü2øöH-I¶ĻĮѵÄĶ¬Ź±£¬ÓŠ1øöH-H¶ĻĮŃ ¢Żø÷×é·ÖÅØ¶Č±£³Ö²»±ä
¢Žc£ØHI£©£ŗc£ØH2£©£ŗc£ØI2£©=2£ŗ1£ŗ1
£Ø4£©ŅŃÖŖÓŠ¹Ų¼üÄÜŹż¾Ż£ŗI2-151kJ/mol”¢H2-436kJ/mol”¢HI-298kJ/mol£¬Ōņµ±ÓŠ0.2molHI·Ö½āŹ±µÄÄÜĮæ±ä»ÆŹĒ £ØĢī”°ĪüŹÕ”±»ņ”°·Å³ö”±£© kJµÄČČĮ攣
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ
”¾ĢāÄæ”æT ”ꏱ£¬AĘųĢåÓėBĘųĢå·“Ó¦Éś³ÉCĘųĢ壬·“Ó¦¹ż³ĢÖŠA”¢B”¢CÅØ¶Č±ä»ÆČēĶ¼(¢ń)ĖłŹ¾£¬Čō±£³ÖĘäĖūĢõ¼ž²»±ä£¬ĪĀ¶Č·Ö±šĪŖT1ŗĶT2Ź±£¬BµÄĢå»ż·ÖŹżÓėŹ±¼äµÄ¹ŲĻµČēĶ¼(¢ņ)ĖłŹ¾”£

øł¾ŻŅŌÉĻĢõ¼ž£¬»Ų“šĻĀĮŠĪŹĢā£ŗ
£Ø1£©AÓėB·“Ӧɜ³ÉCµÄ»Æѧ·½³ĢŹ½ĪŖ £¬Õż·“Ó¦ĪŖ________£ØĢī”°ĪüČČ”±»ņ”°·ÅČČ”±£©·“Ó¦”£
£Ø2£©ŌŚĆܱÕČŻĘ÷ÖŠ£¬¼ÓČė2 mol AŗĶ6 mol B”£
¢Ł µ±·“Ó¦“ļµ½Ę½ŗāŹ±£¬ AŗĶBµÄÅØ¶Č±ČŹĒ_______£»AŗĶBµÄ×Ŗ»ÆĀŹÖ®±ČŹĒ_______”£
¢Ś ÉżøßĘ½ŗāĢåĻµµÄĪĀ¶Č(±£³ÖĢå»ż²»±ä)£¬»ģŗĻĘųĢåµÄĘ½¾łĻą¶Ō·Ö×ÓÖŹĮæ________”££ØĢī”°±ä“ó”±”¢”°±äŠ””±»ņ”°²»±ä”±£©
¢Ū µ±“ļµ½Ę½ŗāŹ±£¬³äČėė²Ęų£¬²¢±£³ÖŃ¹Ēæ²»±ä£¬Ę½ŗā½«____£ØĢī”°ÕżĻņ”±”¢”°ÄęĻņ”±»ņ”°²»”±£©ŅĘ¶Æ”£
²éæ““š°øŗĶ½āĪö>>
¹ś¼ŹŃ§Š£ÓÅŃ” - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com