
【题目】氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如图所示:

(1)写出反应I、II的化学方程式(不必写反应条件):
I、 ;II ;III、2HI![]() H2+I2
H2+I2
(2)整个过程中起到了催化作用的物质是 (写化学式)。
(3)一定温度下,向2L密闭容器中加入1molHI(g),发生反应III,生成的I2为气体,H2物质的量随时间的变化如图所示。则0-2min内的平均反应速率v(HI)= ,能作为该反应达到平衡状态判断依据的是 。
①n(H2)=n(I2) ②压强不再变化 ③气体密度不再变化
④2个H-I断裂的同时,有1个H-H断裂 ⑤各组分浓度保持不变
⑥c(HI):c(H2):c(I2)=2:1:1
(4)已知有关键能数据:I2-151kJ/mol、H2-436kJ/mol、HI-298kJ/mol,则当有0.2molHI分解时的能量变化是 (填“吸收”或“放出”) kJ的热量。
【答案】(1)SO2+2H2O+I2=H2SO4+2HI;II、2H2SO4=2SO2+O2+2H2O;
(2)SO2、I2(3)0.05mol/(L·min),④⑤(4)吸收,0.9
【解析】
试题分析:(1)根据示意图可判断反应I是碘氧化二氧化硫,方程式为SO2+2H2O+I2=H2SO4+2HI;反应II是硫酸分解,方程式为2H2SO4=2SO2+O2+2H2O;
(2)根据以上3个方程式可知反应的实质是水分解产生氢气和氧气,碘、二氧化硫虽然参与反应,但最终又产生,即二者在反应前后质量和性质不变,因此整个过程中起到了催化作用的物质是SO2、I2。
(3)由图可知2min内氢气的物质的量增加了0.1mol,则氢气的浓度为0.1mol÷2L=0.05mol/L,用氢气表示的化学反应速率为0.05mol/L÷2min=0.025mol/(L·min),反应速率之比是相应的化学计量数之比,则用HI表示的反应速率是0.025mol/(L·min)×2=0.05mol/(L·min);①n(H2)=n(I2),没有明确反应方向,不变判断反应是否平衡;②压强自始至终不再变化,不能判断平衡;③密度是气体的质量和容器容积的比值,气体自始至终密度不再变化,不能判断平衡;④2个H-I断裂的同时,有1个H-H断裂,正逆反应速率相等,能判断反应是否平衡;⑤各组分浓度保持不变是判断平衡的标志;⑥(HI):c(H2):c(I2)=2:1:1,没有明确反应方向,不变判断反应是否平衡,答案选④⑤;
(4)焓变等于反应物总键能和生成物总键能之差,则碘化氢分解的焓变=2×298kJ/mol —151kJ/mol—436kJ/mol=+9kJ/mol,则当有0.2molHI分解时的能量变化是吸收0.9kJ的热量。


科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,错误的是

A.装置①用来电解饱和食盐水,c电极产生的气体能使湿润的淀粉KI试纸变蓝
B.装置②可用于收集H2、NH3、Cl2、HCl、NO2
C.装置③检查乙炔的还原性
D.装置④可用于干燥、收集氨气、并吸收多余的氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮和硫的化合物在工农业生产、生活中具有重要应用。请回答下列问题:
(1)航天领域中常用N2H4作为火箭发射的助燃剂。N2H4与氨气相似,是一种碱性气体,易溶于水,生成弱碱N2H4·H2O。用电离方程式表示N2H4·H2O显碱性的原因 。
(2)在恒温条件下,1 mol NO2和足量C发生反应:2NO2(g)+2C(s)![]() N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
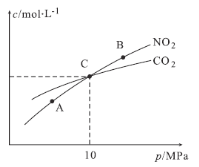
①A、B两点的浓度平衡常数关系:Kc(A) Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是 (填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp= (列出表达式并计算结果。Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)亚硝酸的电离平衡常数Ka=5.1×10-4(298K)。它的性质和硝酸很类似。
①已知298K 时,H2CO的Ka1=4.2×10-7 ;Ka2=5.61×10-11。向含有2mol碳酸钠的溶液中加入1mol的HNO2后,则溶液中CO32-、HCO3-和NO2-的离子浓度由大到小是 。
②将10mL0.1mol/L的亚硝酸溶液加入到10mL0.1mol/L氨水(已知在25℃时,一水合氨的Ki= 1.8×10-5)中,最后所得溶液为________(填“酸性”、“碱性”或者“中性”)。
(4)一种煤炭脱硫技术可以把硫元素以CaSO4的形成固定下来,但产生的CO又会与CaSO4发生化学反应,相关的热化学方程式如下:
①CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
CaO(s)+SO2(g)+CO2(g)△H = +210.5kJmol-1
②CaSO4(s)+ 4CO(g)![]() CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
CaS(s)+ 4CO2(g) △H = -189.2kJmol-1
反应CaO(s)+3CO(g)+SO2(g) ![]() CaS(s)+3CO2(g) △H= kJmol-1;
CaS(s)+3CO2(g) △H= kJmol-1;
(5)H2S气体溶于水形成的氢硫酸是一种二元弱酸,25℃时,在0.10 mol·L-1H2S溶液中,通人HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2-)关系如图所示(忽略溶液体积的变化、H2S的挥发)。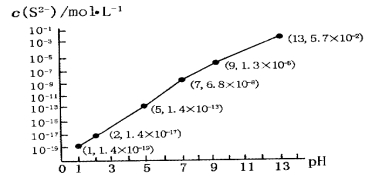
①pH=13时,溶液中的c(H2S)+c(HS-)=__________mol·L-1;
②某溶液含0.010 mol·L-1Fe2+和0.10 mol·L-1H2S,当溶液pH=______时,Fe2+开始沉淀。【已知:KSP(FeS)=1.4×10-19】
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分。请回答下列问题:

(1)上述元素中,属于s区的是________________________(填元素符号)。
(2)写出元素⑩的基态原子的电子排布式___________________________。
(3)元素第一电离能为⑤____________⑨(填“大于”或“小于”)。
(4)元素③气态氢化物的中心原子有___________对弧对电子,其VSEPR模型为_________________;中心原子的杂化类型为_______________;该分子为_________________分子(填“极性”或“非极性”)。向AgNO3溶液中逐滴加入其水溶液,可观察到的现象为___________ ___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如图所示。下列有关说法错误的是
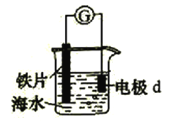
A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2+ 2H2O + 4e = 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H++ 2e = H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、某研究性学习小组为了验证CH4是否具有还原性,设计了如下实验:

(1)实验过程中观察到无水CuSO4逐渐变蓝,澄清石灰水出现浑浊现象,则CH4与CuO反应的化学方程式为____ __ 。
(2)研究小组将CH4通入溴水时,发现溴水逐渐褪色,你认为原因可能是____ 。
请设计一个实验方案证明你的结论(用文字表示,不必画实验装置图)___ _____________ 。
II、(1)工业上用电石-乙炔生产氯乙烯的反应如下:CaO+3C![]() CaC2+CO
CaC2+CO
CaC2+2H2O![]() CH≡CH+Ca(OH)2 CH≡CH+HCl
CH≡CH+Ca(OH)2 CH≡CH+HCl ![]() CH2=CHCl
CH2=CHCl
电石-乙炔法的优点是流程简单,产品纯度高,而且不依赖与石油资源。
电石-乙炔法的缺点是: 、 。
(2)乙烷和氯气反应可制得ClCH2CH2Cl,ClCH2CH2Cl加热分解得到氯乙烯和氯化氢。请设计以乙烯和氯气为原料制取氯乙烯的方案(其他原料自选),用化学方程式表示(不必注明反应条件)。要求:①反应产生的氯化氢必须用于氯乙烯的制备;②不再产生其他废液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明正确的是

(1)和金属钠作用时,断裂______
(2)和浓硫酸共热至170 ℃时,断裂______
(3)和乙酸、浓硫酸共热时,断裂_______
(4)在铜催化下和氧气反应时,断裂_____
(5)与氢卤酸反应时,断裂______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山喷发所产生的硫黄可用于生产重要的化工原料硫酸。某企业用下图所示的工艺流程生产硫酸:


请回答下列问题:
(1)硫酸的用途非常广泛,可应用于下列哪些方面 。
A.橡胶的硫化
B.表面活性剂“烷基苯磺酸钠”的合成
C.铅蓄电池的生产
D.过磷酸钙的制备
(2)为充分利用反应放出的热量,接触室中应安装 (填设备名称)。吸收塔中填充有许多瓷管,其作用是 。
(3)如果进入接触室的混合气(含SO2体积分数为7%、O2为11%、N2为82%)中SO2平衡转化率与温度及压强的关系如图所示。在实际生产中,SO2催化氧化反应的条件选择常压和450℃ ,而没有选择SO2转化率更高的B或C点对应的反应条件,其原因分别是 ; 。
(4)为使硫黄充分燃烧,经流量计l通入燃烧室的氧气过量50%;为提高SO2转化率,经流量计2的氧气量为接触室中二氧化硫完全氧化时理论需氧量的2.5倍;则生产过程中流经流量计l和流量计2的空气体积比应为 。假设接触室中SO2的转化率为95%,b管排出的尾气中二氧化硫的体积分数为 。(空气中氧气的体积分数按0.2计),
(5)工业对硫酸厂尾气的处理方法一般是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。其中B的单质在常温下为双原子分子,它与A的单质可形成分子X,X的水溶液呈碱性;D的简单阳离子与X具有相同电子数,且D是同周期中简单离子半径最小的元素;E元素的原子最外层比次外层少两个电子,C、F两种元素的原子最外层共有13个电子。则:
(1)X的分子式为
(2)E的简单阴离子的原子结构简图
(3)F在元素周期表中的位置是 (填周期和族)
(4)B、C、E分别与A形成的化合物中最稳定的是 (写化学式);
(5)A与C形成的化合物中含非极性键的化合物的电子式为_____________.
(6)D的最高价氧化物的水化物与E的最高价氧化物的水化物反应的化学反应方程式
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com