
【题目】根据下面的元素周期表的图示,回答问题。
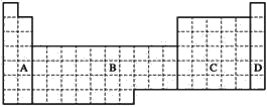
(1)全部是金属元素的区域为________。
(2)有人认为形成化合物最多的元素不是第ⅣA族的碳元素,而是另一种短周期元素。请你根据学过的化学知识判断,这一元素是________(写元素符号)。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置________。
②甲、乙两元素相比较,金属性较强的是________(填名称),可以验证该结论的实验是________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
【答案】B H 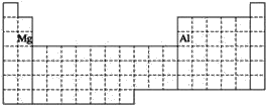 镁 bc
镁 bc
【解析】
(1)A区中H元素为非金属性,B区为过渡元素,全部为金属元素,C区中含有金属与非金属元素,D区为稀有气体,故答案为:B;
(2)有机物大都含有氢元素,非金属的氢化物中含有氢元素,H元素能与大多数的非金属元素形成化合物,形成化合物最多的元素可能是H元素,故答案为:H;
(3)甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,则甲为Al,乙元素原子核外M电子层与K电子层上的电子数相等,则乙为Mg;
①Al位于第三周期ⅢA族,Mg位于第三周期ⅡA族, ;
;
②同周期自左而右元素金属性减弱,故金属性Mg>Al,则
a.金属在空气中放置已久,表面生成氧化物保护膜,阻止金属与水反应,不能比较金属性强弱,故错误;
b.将除掉表面氧化膜的这两种元素的单质分别和同浓度的盐酸反应,反应越剧烈,则元素金属性越强,故正确;
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液,比较碱性强弱,加入Mg粉的溶液呈浅红色,而加入Al粉的无明显现象,故正确;
d.二者都是金属元素,不能比较氢化物的稳定性判断金属性强弱,故错误;
综上bc正确。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】乙酸乙酯是中学化学中的重要物质。小明通过自主学习成功地制取并提纯了乙酸乙酯:
小明的知识储备:
①乙醇能和氯化钙形成CaCl2·6C2H5OH
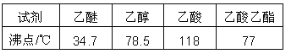
②有关物质的沸点:
制备过程:
装置如图所示,A中放有浓硫酸,B中放有10mL无水乙醇和5mL冰醋酸,D中放有滴有酚酞的饱和碳酸钠溶液。迅速升温到170℃进行反应。
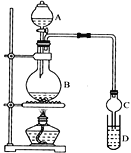
(1)请补充出乙酸与乙醇发生酯化反应的化学方程式___。
(2)实验装置还缺少___。
(3)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是___。(填字母)
A.25mL B.50mL C.250mL D.500mL
(4)小明在D中观察到了明显的的分层现象,其下层显___色。
产品提纯:
①将D中混合物转入分液漏斗进行分液。②有机层用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。③将粗产物蒸馏,收集馏分,得到纯净干燥的乙酸乙酯。
(5)操作②的目的为洗去___,操作③中,应收集___℃馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成苯甲酸的原理、有关数据及装置示意图如图:

某学习小组在实验室制备、分离、提纯苯甲酸,步骤如下:
(一)制备苯甲酸
在三颈瓶中加入甲苯、水和沸石,搅拌并加热至沸腾,然后加入过量高锰酸钾,继续搅拌约4~5h,直到甲苯层几乎近于消失、回流液不再出现油珠,停止加热和搅拌,静置。
(二)分离提纯
在反应混合物中加入一定量草酸(H2C2O4)充分反应,过滤、洗涤,将滤液放在冰水浴中冷却,然后用浓盐酸酸化,减压过滤,再用少量冷水洗涤,干燥,得到粗产品。
请回答下列问题:
(1)装置a的名称是__,其作用为__。
(2)甲苯被高锰酸钾氧化的原理如下,请完成并配平该化学方程式。
________![]() +________KMnO4
+________KMnO4![]() ________
________![]() +________MnO2↓+________H2O+___________
+________MnO2↓+________H2O+___________
(3)分离提纯过程中为了除去过量的KMnO4,加入一种二元弱酸草酸,反应过程中有碳酸氢盐和无色气体生成。请用离子方程式表示反应原理__。
(4)产品减压过滤时用冷水洗涤的原因是__。
(5)选用下列_操作,可以将粗产品进一步提纯(选填字母)。
A.溶于水后过滤 B.溶于乙醇后蒸馏 C.用甲苯萃取后分液 D.升华
(6)以酚酞为指示剂,用标准浓度KOH溶液滴定苯甲酸的乙醇溶液,可测定产品纯度,滴定终点的现象是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
![]()
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组由有机物A制备G的合成路线如图所示:

请回答下列问题:
(1)A的结构简式为________;D中含氧官能团的名称是________。
(2)反应③的试剂和反应条件分别是________,该反应类型是________。
(3)已知吡啶是一种有机碱,在反应⑤中的作用是________。
(4)反应⑤的化学方程式为________。
(5)G的相对分子质量为________。
(6)H是G的同分异构体,其苯环上的取代基与G的相同但位置不同,则H可能的结构有________种。
(7)参照上述合成路线,以![]() 和
和![]()
![]() 为原料,经三步合成某化工产品
为原料,经三步合成某化工产品![]()
![]()
![]() 的路线为________(其他无机试剂任选)。
的路线为________(其他无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组收集了一种合金进行以下探究(已知铜元素的焰色反应呈绿色)。
(1)外观暗灰色,表皮光滑;
(2)在酒精灯外焰上灼烧,火焰呈绿色,合金片熔化,但不滴落;
(3)取刮去表皮的合金10 g,放入足量的稀硫酸中,收集到标准状况下的H2 8.96 L;
(4)另取刮去表皮的合金10 g,放入足量的NaOH溶液中,也收集到标准状况下的H2 8.96 L。
试据此判断,该合金中一定含有的元素是________(写元素符号);可能含有的元素是________(填选项编号)。
a.Ag b.Mg
c.Na d.Fe
如果该合金中只含2种元素,则二者的质量比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是![]()
![]()
①质子数相同的微粒一定属于同一种元素![]()
②同位素的性质相同![]()
③质子数相同、电子数也相同的微粒,不可能是一种分子和一种离子![]()
④电子数相同的微粒不一定是同一种元素![]()
⑤一种元素只能有一种质量数![]()
⑥某种元素的相对原子质量取整数,就是其质量数![]()
⑦![]() 中
中![]() 与
与![]() 的原子个数之比与NaCl中的
的原子个数之比与NaCl中的![]() 与
与![]() 的原子个数之比相等
的原子个数之比相等
A.②③⑤⑥⑦B.①②④⑤C.①②⑤⑥D.③④⑥⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在①蛋白质 ②油脂 ③葡萄糖 ④纤维素⑤淀粉五种物质中,不能水解的是______(填序号),在人体中不能直接被消化吸收的是________(填序号),蛋白质水解后最终生成__________(填名称),油脂水解后得到醇的结构简式是_________。
(2)某学生设计用如下实验方案用以检验淀粉水解的情况:

由水解液分别进行上述实验后的现象,可得出的实验结论应该是________(填序号)。
A.淀粉尚有部分未水解
B.淀粉已完全水解
C.淀粉没有水解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com