
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
【答案】Al Mg+2H+=Mg2++H2↑ (1)
【解析】
(1)比较镁、铝的金属性强弱,根据与同浓度的稀盐酸反应时放出气体的快慢,依据实验现象,判断金属性的强弱;
(2)根据离子方程式,物质的量相等的Mg、Al,计算出氢气的物质的量,参照实验现象,判断出金属的种类;
(3)比较金属性强弱的方法看的是剧烈程度,而不是产生气体的多少;
(1)反应初始时观察到a试管上的气球体积大,则说明与同浓度的稀盐酸反应时a试管中的金属反应速率快,反应速率快的金属性强,所以试管中是Al与盐酸反应,即试管b内加入的金属为Al;
(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球a中生成的气体多,Mg、Al分别与稀盐酸反应的离子方程式为:Mg+2H+=Mg2++ H2↑、2Al+6H+=2A13+ +3H2↑根据离子方程式可知,物质的量相等的Mg、Al与足量的盐酸反应时Al生成的氢气多,则a中为Al与盐酸反应,所以试管b中反应的离子方程式为:Mg+2H+=Mg2++ H2↑;
(3)与同浓度的稀盐酸反应速率越快,则金属性越强金属与盐酸反应生成氢气的多少不能证明金属性的强弱,所以实验( 1 )能证明镁的金属性强于铝;


 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案科目:高中化学 来源: 题型:
【题目】BF3与一定量的水形成(H2O)2·BF3,一定条件下(H2O)2·BF3可发生如图转化,下列说法中正确的是
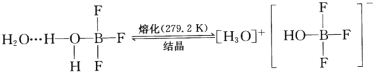
A.(H2O)2·BF3熔化后得到的物质属于离子晶体
B.(H2O)2·BF3分子间存在着配位键和氢键
C.BF3是仅含极性共价键的非极性分子
D.基态B原子核外电子的空间运动状态有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
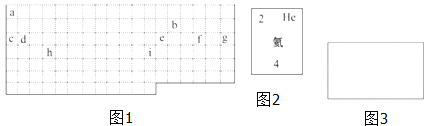
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和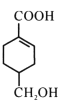 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

已知: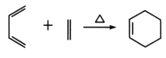
![]() RCOOH
RCOOH
(1)A的结构简式为__________
(2)写出一个题目涉及的非含氧官能团的名称__________
(3)关于C的说法正确的是_______________(填字母代号)
a 有酸性 b 分子中有一个甲基
c 是缩聚产物 d 能发生取代反应
(4) 发生缩聚形成的高聚物的结构简式为_____
发生缩聚形成的高聚物的结构简式为_____
(5)E→F的化学方程式为_______。
(6)以A为起始原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下面的元素周期表的图示,回答问题。
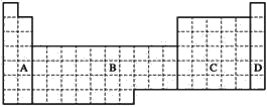
(1)全部是金属元素的区域为________。
(2)有人认为形成化合物最多的元素不是第ⅣA族的碳元素,而是另一种短周期元素。请你根据学过的化学知识判断,这一元素是________(写元素符号)。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置________。
②甲、乙两元素相比较,金属性较强的是________(填名称),可以验证该结论的实验是________。
a.将在空气中放置已久的这两种元素的块状单质分别放入热水中
b.将这两种元素的单质粉末分别和同浓度的盐酸反应
c.将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
d.比较这两种元素的气态氢化物的稳定性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,将0.1mol/LNaOH溶液加入20mL0.1mol/LCH3COOH溶液中,所加入溶液体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是
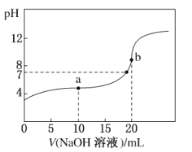
A.pH=7时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.a点所示的溶液中c(CH3COOH)>c(CH3COO-)
C.b点所示的溶液中c(CH3COOH)+c(H+)=c(OH-)
D.a、b两点所示的溶液中水的电离程度相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(本题10分)
(1)相对分子质量为72的烷烃,它的一氯代物只有一种,此烷烃的结构简式为______。
(2)某气态烷烃和一气态烯烃组成的混合气体在同温、同压下对氢气的相对密度为13,取标准状况下此混合气体4.48L,通入足量的溴水,溴水质量增加2.8g,此两种烃的组成为____(填分子式)。
(3)某烃是一种比水轻的油状液体,相对分子质量为78,碳元素与氢元素的质量比为12:1,不能使溴水和酸性高锰酸钾溶液褪色。写出此烃发生取代反应的化学方程式(任意写一个即可)___________。
(4)2.3g某有机物A完全燃烧后,生成0.1molCO2和 2.7gH2O,测得该化合物的蒸气与空气的相对密度是1.6,已知此有机物可以与Na发生置换反应,写出此有机物与乙酸发生酯化反应的化学方程式______。
(5) 有机物的结构可用“键线式”表示,如:CH3-CH=CH-CH3可简写为![]() 。
。![]() 可简写为
可简写为![]() 。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,
。玫瑰的香味物质中包含苧烯,苧烯的键线式如右图,![]() ,苧烯的分子式为____。
,苧烯的分子式为____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原油价格的下跌,加剧能源的过度开采,因此更要开展汽油的有机合成的研究。以下是一种合成汽油的路线:

已知:R-CH2-CHO+R1-CH2-CHO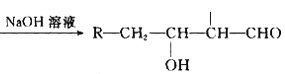
2R-CH2-Cl+2Na![]() R-CH2-CH2-R+2NaCl
R-CH2-CH2-R+2NaCl
CH3-CH=CH2+H-Cl
请根据以上信息回答下列问题:
(1)在反应①—⑥中,属于加成反应的是_________,B的分子式为 ________。
(2)A中官能团名称为_________, E的名称为 ____________。
(3)写出下列反应方程式:E→F_____________________H→G_________________。
(4)H也能与NaOH溶液反应,其反应方程式为:_________________________。
(5)D的核磁共振氢谱有____组吸收峰。写出符合下列条件D的所有同分异构体___________。
①链状结构,②能与钠反应生成气体,③不饱和碳上不与含氧官能团直接相连。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列叙述,写出元素名称并画出原子结构示意图:
信息 | 元素名称 | 原子结构示意图 |
A元素原子核外M层电子数是L层电子数的一半 | ____ | ____ |
B元素原子最外层电子数是次外层电子数的1.5倍 | ____ | ____ |
C元素+1价离子C+的电子层排布与Ne相同 | ____ | ____ |
D元素原子次外层电子数是最外层电子数的 | ____ | ____ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com