
【题目】25°C时,将0.1mol/LNaOH溶液加入20mL0.1mol/LCH3COOH溶液中,所加入溶液体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是
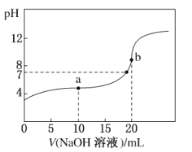
A.pH=7时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.a点所示的溶液中c(CH3COOH)>c(CH3COO-)
C.b点所示的溶液中c(CH3COOH)+c(H+)=c(OH-)
D.a、b两点所示的溶液中水的电离程度相同
【答案】C
【解析】
分析题给关系曲线图,当加入的VNaOH=10mL时,溶液溶质为等物质的量的CH3COOH、CH3COONa的混合溶液,且溶液pH<7。当加入的VNaOH=20mL时,CH3COOH与NaOH完全反应,此时溶液溶质为CH3COONa,溶液的pH>7。据此进行分析。
A.根据电荷守恒有:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),当pH=7时,c(H+)=c(OH-),则c(Na+)=c(CH3COO-),A项错误;
B.a点时,加入的VNaOH=10mL,此时溶液溶质为等物质的量的CH3COOH、CH3COONa,则根据物料守恒有:c(CH3COO-)+c(CH3COOH)=2c(Na+),结合电荷守恒:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),则:c(CH3COOH)+2c(H+)=2c(OH-)+c(CH3COO-),由图像可知,a点时溶液的pH<7,即c(H+)>c(OH-),故c(CH3COOH)<c(CH3COO-),B项错误;
C.由分析可知,b点所示的溶液溶质为CH3COONa,根据质子守恒有:c(CH3COOH)+c(H+)=c(OH-),C项正确;
D.由分析可知,a点溶液溶质为等物质的量的CH3COOH、CH3COONa的混合溶液,且溶液pH<7,对水的电离有抑制作用;b点溶液溶质为CH3COONa,CH3COO-会水解,促进水的电离,故a、b两点所示的溶液中水的电离程度不相同,D项错误;
答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸(![]() )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(![]() )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是

A.电子由金属阳极DSA经导线流入直流电源
B.阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O
+2H2O
C.每转移1mole-时,阳极电解质溶液的质量减少8g
D.反应结束后阳极区pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )

A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.一定温度下,反应MgCl2(l)=Mg(1)+Cl2(g)的 △H>0 △S>0
B.用N2(g)+3H2(g)=2NH3(g)△H<0设计的燃料电池,N2(g)在正极上进行反应
C.氯化镁溶液加热蒸干得不到纯净氯化镁固体
D.常温下,向饱和![]() 溶液中加少量
溶液中加少量![]() 粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下
粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下![]()
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图所示,下列说法错误的是

A.分子式为C8H7OClB.在同一平面上的碳原子最多有8个
C.1mol苯氯乙酮最多可与3molH2发生加成反应D.核磁共振氢谱有4个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某微粒A的结构示意图为![]()
(1)若A是原子,则A的元素符号为__;若A是带一个正电荷的阳离子,则X=___
(2)若X=8,则此阴离子与(1)中带一个正电荷的阳离子形成一种常见化合物的化学式是___,它是不是电解质(填是或否)____。写出此化合物与盐酸反应的化学方程式:________________________________
(3)1mol微粒A含有10mol电子,下列微粒各1mol,也含有10mol电子的有:___(填序号)
①CH4 ②H2O2 ③HF ④Al3+ ⑤Cl- ⑥NH4+
(4)若A的阳离子为An+且质量数为a,则其质子数为____________,中子数为_______________(用含有a,n的代数式表达)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. PH=1的醋酸加水稀释到原体积的100倍,稀释后PH=3
B. 室温 pH=3的醋酸溶液和pH=11的Ba(OH)2溶液等体积混合后溶液呈酸性
C. 室温pH相同的NH4Cl溶液和CH3COOH溶液,由水电离产生的c(H+)相同
D. 某温度下,水的离子积常数为1×10-12,该温度下PH=7的溶液呈中性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com