
【题目】对氨基苯甲酸(![]() )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(![]() )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是

A.电子由金属阳极DSA经导线流入直流电源
B.阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O
+2H2O
C.每转移1mole-时,阳极电解质溶液的质量减少8g
D.反应结束后阳极区pH增大
【答案】AB
【解析】
该装置为电解池,右侧生成氧气,则右侧为阳极,电极反应式为![]() ,左侧为阴极,据此分析解答。
,左侧为阴极,据此分析解答。
A. 该电解池右侧为阳极,失电子发生氧化反应,则电子由金属阳极DSA经导线流入直流电源,故A正确;
B. 阴极得电子发生还原反应生成氨基苯甲酸,则阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O,故B正确;
+2H2O,故B正确;
C. 阳极发生反应![]() ,氢离子移动向阴极,当转移4mole-时,阳极电解质溶液减少2mol水,则每转移1mole-时,阳极电解质溶液减少0.5mol水,质量为9g,故C错误;
,氢离子移动向阴极,当转移4mole-时,阳极电解质溶液减少2mol水,则每转移1mole-时,阳极电解质溶液减少0.5mol水,质量为9g,故C错误;
D. 阳极发生反应![]() ,氢离子移动向阴极,则反应结束后阳极区硫酸浓度会增大,pH减小,故D错误;
,氢离子移动向阴极,则反应结束后阳极区硫酸浓度会增大,pH减小,故D错误;
故选AB。


科目:高中化学 来源: 题型:
【题目】25℃时,向50mL含有0.1molCl2的氯水中滴加2mol·L1的NaOH溶液,得到溶液pH随加入NaOH溶液体积的变化如图所示。下列说法正确的是
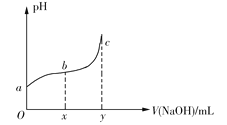
A.若a点pH=4,且c(Cl)=mc(HClO),则HClO的电离平衡常数为![]()
B.若x=100,b点对应溶液中,c(OH)>c(H+),可用pH试纸测定其pH
C.若y=200,c点对应溶液中,c(OH)c(H+)=2c(Cl)+c(HClO)
D.b→c段,随NaOH溶液的滴入,![]() 逐渐增大
逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种电池的电池反应式为:Li+2Li0.35NiO2![]() 2Li0.85NiO2,下列说法不正确的是( )
2Li0.85NiO2,下列说法不正确的是( )
A.放电时,负极的电极反应式:Li-e-=Li+
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应
C.该电池不能用水溶液作为电解质溶液
D.放电过程中Li+向负极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BF3与一定量的水形成(H2O)2·BF3,一定条件下(H2O)2·BF3可发生如图转化,下列说法中正确的是
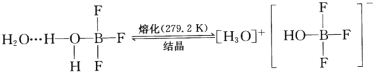
A.(H2O)2·BF3熔化后得到的物质属于离子晶体
B.(H2O)2·BF3分子间存在着配位键和氢键
C.BF3是仅含极性共价键的非极性分子
D.基态B原子核外电子的空间运动状态有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产、生活等实际应用,不能用勒夏特列原理解释的是( )
A. 溴水中有下列平衡Br2+H2O ![]() HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
HBr + HBrO,当加入AgNO3溶液后溶液颜色变浅
B. 合成氨工业中使用铁触媒做催化剂
C. 用饱和食盐水除去氯气中氯化氢杂质
D. 对2HI(g)![]() H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
H2(g)+I2(g),保持容器体积不变,通入氢气可使平衡体系颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员研究了在Cu—ZnO—ZrO2催化剂上CO2加氢制甲醇过程中水的作用机理,其主反应历程如图所示(H2→*H+*H)。下列说法错误的是

A.二氧化碳加氢制甲醇的过程中原子利用率小于100%
B.带*标记的物质是该反应历程中的中间产物
C.Cu—ZnO—ZrO2可提高甲醇的产率
D.第④步的反应式为*HO+*H→H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
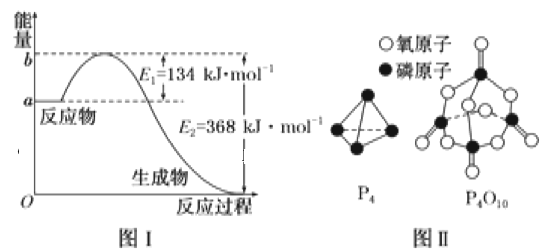
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E2的变化是__(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能(kJ·mol-1) | 198 | 360 | 498 | x |
已知1mol白磷(P4)完全燃烧放热为1194kJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=__kJ·mol-1。
(3)PCl5是一种重要的含磷化合物,在有机合成中用作氯化剂。某温度时,向2.0L恒温恒容密闭容器中充入1.0molPCl5,发生反应PCl5(g)![]() PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
PCl3(g)+C12(g)ΔH=+124kJ·mol-1。反应过程中测定的部分数据见下表:
时间t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.2 | 0.2 |
反应在前50s的平均速率v(PCl5)=__。在该温度下,若起始时充入0.5molPCl5和amolCl2,平衡时PCl5的转化率仍为20%,则a=__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25°C时,将0.1mol/LNaOH溶液加入20mL0.1mol/LCH3COOH溶液中,所加入溶液体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是
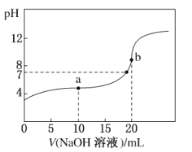
A.pH=7时,c(CH3COO-)+c(CH3COOH)=c(Na+)
B.a点所示的溶液中c(CH3COOH)>c(CH3COO-)
C.b点所示的溶液中c(CH3COOH)+c(H+)=c(OH-)
D.a、b两点所示的溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com