
【题目】BF3与一定量的水形成(H2O)2·BF3,一定条件下(H2O)2·BF3可发生如图转化,下列说法中正确的是
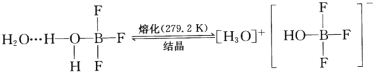
A.(H2O)2·BF3熔化后得到的物质属于离子晶体
B.(H2O)2·BF3分子间存在着配位键和氢键
C.BF3是仅含极性共价键的非极性分子
D.基态B原子核外电子的空间运动状态有5种
科目:高中化学 来源: 题型:
【题目】下图为有关分子在催化剂作用下发生转化的示意图,下列叙述正确的是( )。
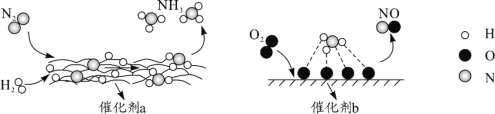
A.N2→NH3,NH3→NO均属于氮的固定
B.催化剂a作用下氮原子发生了氧化反应
C.催化剂a、b表面均发生了极性共价键的断裂
D.使用催化剂a、b均可以提高单位时间内生成物的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将5.32 g纯Fe溶于足量稀H2SO4中,在加热条件下用2.53 g KNO3去氧化溶液中的Fe2+,充分反应后余下的Fe2+还原0.009 mol Cl2才能完全氧化,则KNO3的还原产物中N的化合价是
A.–3B.+4C.+3D.+2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 | B.制有色玻璃 |
C.制永久性模具 | D.制造柴油机 |
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯是中学化学中的重要物质。小明通过自主学习成功地制取并提纯了乙酸乙酯:
小明的知识储备:
①乙醇能和氯化钙形成CaCl2·6C2H5OH
②有关物质的沸点:
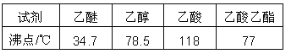
制备过程:
装置如图所示,A中放有浓硫酸,B中放有10mL无水乙醇和5mL冰醋酸,D中放有滴有酚酞的饱和碳酸钠溶液。迅速升温到170℃进行反应。
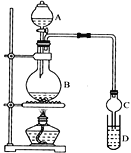
(1)请补充出乙酸与乙醇发生酯化反应的化学方程式___。
(2)实验装置还缺少___。
(3)实验过程中滴加大约3mL浓硫酸,B的容积最合适的是___。(填字母)
A.25mL B.50mL C.250mL D.500mL
(4)小明在D中观察到了明显的的分层现象,其下层显___色。
产品提纯:
①将D中混合物转入分液漏斗进行分液。②有机层用5mL饱和氯化钙溶液洗涤,最后用水洗涤。有机层倒入一干燥的烧瓶中,用无水硫酸镁干燥,得粗产物。③将粗产物蒸馏,收集馏分,得到纯净干燥的乙酸乙酯。
(5)操作②的目的为洗去___,操作③中,应收集___℃馏分。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸(![]() )是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(
)是一种用途广泛的化工产品和医药中间体,以对硝基苯甲酸(![]() )为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是
)为原料,采用电解法合成对氨基苯甲酸的装置如图。下列说法正确的是

A.电子由金属阳极DSA经导线流入直流电源
B.阴极的主要电极反应式为![]() +6e-+6H+→
+6e-+6H+→![]() +2H2O
+2H2O
C.每转移1mole-时,阳极电解质溶液的质量减少8g
D.反应结束后阳极区pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在甲、乙、丙、丁四个恒容密闭容器中投入H2和I2,发生反应:H2(g)+I2(g) ![]() 2HI(g)。反应体系中各物质浓度的有关数据如下。
2HI(g)。反应体系中各物质浓度的有关数据如下。
容器 | 起始浓度 | 平衡浓度 | |
c(H2)/(mol·L-1) | c(I2)/(mol·L-1) | c(HI)/(mol·L-1) | |
甲 | 0.01 | 0.01 | 0.004 |
乙 | 0.01 | 0.02 | a |
丙 | 0.02 | 0.01 | b |
丁 | 0.02 | 0.02 | c |
下列判断不正确的是
A. HI的平衡浓度:a=b>0.004,c=0.008 B. 平衡时,H2的转化率:丁>甲
C. 平衡时,乙中H2的转化率大于20% D. 丙中条件下,该反应的平衡常数K=0.25
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。锂离子电池广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜中主要含有钴酸锂(LiCoO2)、Al等,处理该废料的一种工艺如下图所示:

回答下列问题:
(1)铝钴膜在处理前初步进行粉碎的目的是________________________。
(2)能够提高“碱浸”效率的方法有________________________(至少写两种)。
(3)“碱浸”时Al溶解的离子方程式为________________________。
(4)“酸溶”时加入H2O2的目的是________________________。
(5)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是_______________________。
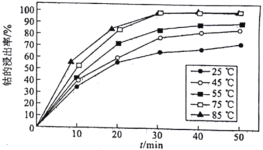
(6)配制250 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外还需要________。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该钴的氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com