
【题目】A(C3H6)是基本有机化工原料,由A制备聚合物C和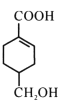 合成路线如图所示(部分条件略去)。
合成路线如图所示(部分条件略去)。

已知: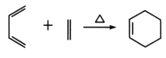
![]() RCOOH
RCOOH
(1)A的结构简式为__________
(2)写出一个题目涉及的非含氧官能团的名称__________
(3)关于C的说法正确的是_______________(填字母代号)
a 有酸性 b 分子中有一个甲基
c 是缩聚产物 d 能发生取代反应
(4) 发生缩聚形成的高聚物的结构简式为_____
发生缩聚形成的高聚物的结构简式为_____
(5)E→F的化学方程式为_______。
(6)以A为起始原料,选用必要的无机试剂合成![]() ,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
,写出合成路线(用结构简式表示有机物),用箭头表示转化关系,箭头上注明试剂和反应条件)_______。
【答案】CH3CH=CH2 碳碳双键 (氯原子) ad 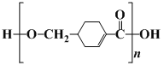
![]() (或其它合理答案)
(或其它合理答案)
【解析】
由B的结构、结合A的分子式,可知A为CH2=CHCH3;CH3CH=CHCOOCH3发生加聚反应得到高聚物。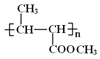 发生水解反应、酸化得到聚合物C,则C为
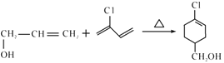
发生水解反应、酸化得到聚合物C,则C为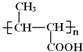 ;A与氯气在高温下反应生成D,D发生水解反应生成E,可知D为CH2=CHCH2Cl;E与CH2=CClCH=CH2发生类似已知信息反应生成F,结合G后产物(
;A与氯气在高温下反应生成D,D发生水解反应生成E,可知D为CH2=CHCH2Cl;E与CH2=CClCH=CH2发生类似已知信息反应生成F,结合G后产物( )结构以及题目所给信息,可知F为
)结构以及题目所给信息,可知F为![]() ,则G为
,则G为![]() 。
。
(1)根据分析可知A为CH2=CHCH3;
(2)CH2=CClCH=CH2的官能团为氯原子,为非含氧官能团;
(3)C为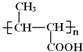 含有羧基,所以具有酸性,该分子为高聚物,所以不止有一个甲基;该物质为含碳碳双键的物质的加聚产物;含有羧基、甲基可以发生取代反应,综上所述选ad;
含有羧基,所以具有酸性,该分子为高聚物,所以不止有一个甲基;该物质为含碳碳双键的物质的加聚产物;含有羧基、甲基可以发生取代反应,综上所述选ad;
(4)![]() 既含有羟基又含有羧基,所以可以发生脱水缩合反应生成
既含有羟基又含有羧基,所以可以发生脱水缩合反应生成![]() ;
;
(5)E到F发生题目所给信息反应,方程式为: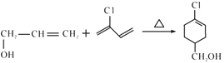 ;
;
(6)A为CH2=CHCH3,对比产物![]() 可知需要加长碳链同时引入羧基,可以参考F到
可知需要加长碳链同时引入羧基,可以参考F到 的过程,烯烃可以和HCl反应生成氯代烃,氯代烃可以和NaCN反应从而加长碳链,同时在i:NaOH、ii:HCl条件下生成COOH,所以合成路线为:
的过程,烯烃可以和HCl反应生成氯代烃,氯代烃可以和NaCN反应从而加长碳链,同时在i:NaOH、ii:HCl条件下生成COOH,所以合成路线为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】氮化硅是一种高温陶瓷材料,它硬度大、熔点高,化学性质稳定,工业上普遍采用高纯硅与纯氮在1 300 ℃反应获得。
(1)根据性质,推测氮化硅陶瓷的用途是________。(填序号)
A.制汽轮机 | B.制有色玻璃 |
C.制永久性模具 | D.制造柴油机 |
(2)写出N的原子结构示意图__________,根据元素周期律知识,请写出氮化硅的化学式_________________。
(3)氮化硅陶瓷抗腐蚀能力强,除氢氟酸外,它不与其他无机酸反应,试推测该陶瓷被氢氟酸腐蚀的化学方程式___________________________________。
(4)现用四氯化硅与氮气在氢气气氛保护下,加强热发生反应,可得较高纯度的氮化硅,反应的化学方程式为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁发给来自美国、英国、日本的三位科学家,表彰他们在锂离子电池方面的研究贡献。锂离子电池广泛应用要求处理锂电池废料以节约资源、保护环境。锂离子二次电池正极铝钴膜中主要含有钴酸锂(LiCoO2)、Al等,处理该废料的一种工艺如下图所示:

回答下列问题:
(1)铝钴膜在处理前初步进行粉碎的目的是________________________。
(2)能够提高“碱浸”效率的方法有________________________(至少写两种)。
(3)“碱浸”时Al溶解的离子方程式为________________________。
(4)“酸溶”时加入H2O2的目的是________________________。
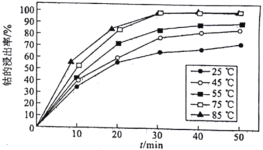
(5)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是_______________________。
(6)配制250 mL 1.0 mol/L (NH4)2C2O4溶液,需要的玻璃仪器除玻璃棒、烧杯外还需要________。
(7)取CoC2O4固体4.41g在空气中加热至300℃,得到钴的氧化物2.41g,则该钴的氧化物的化学式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )

A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的X、Y、Z、W四种短周期元素的原子最外层电子数之和为22,下列说法正确的是
![]()
A. X、Y、W三种元素最低价氢化物的沸点依次升高
B. Z、X、W三种元素氧化物对应水化物的酸性依次增强
C. 由X、W和氢三种元素形成的化合物中只含共价键
D. X、Z形成的二元化合物是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为比较镁、铝的金属性强弱,设计了如下实验:
(1)向两支试管中分别加入3mL同浓度的稀盐酸,再将两块大小相同且纯净的镁片和铝片分别加入试管中,反应完全后观察到如图所示的现象,则试管b内加入的金属为____________(写化学式)。

(2)若加入的两块金属的物质的量相等,且试管中稀盐酸足量,充分反应后,气球状态也如图所示,则试管b中反应的离子方程式为____________。
(3)分析判断,实验________[填“(1)”或“(2)”]能证明镁的金属性强于铝。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氯乙酮是一种具有荷花香味且有强催泪作用的杀伤性化学毒剂,它的结构简式如图所示,下列说法错误的是

A.分子式为C8H7OClB.在同一平面上的碳原子最多有8个
C.1mol苯氯乙酮最多可与3molH2发生加成反应D.核磁共振氢谱有4个吸收峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸在溶剂中的电离实质是酸中的H+转移给溶剂分子,如HCl+H2O=H3O++Cl-。已知H2SO4和HNO3在冰醋酸中的电离平衡常数分别为Kal(H2SO4)=6.3×10-9,Ka(HNO3)=4.2×10-10。下列说法正确的是( )
A.H2SO4在冰醋酸中的电离方程式为H2SO4+2CH3COOH=SO42-+2CH3COOH2+
B.H2SO4在冰醋酸中:![]() =c(HSO4-)+2c(SO42-)+c(CH3COO-)
=c(HSO4-)+2c(SO42-)+c(CH3COO-)
C.浓度均为0.1mol·L-1的H2SO4或HNO3的冰醋酸溶液:pH(H2SO4)>pH(HNO3)
D.向HNO3的冰醋酸溶液中加入冰醋酸, 的值减小
的值减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com