
【题目】近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深。Butylated Hydroxy Toluene(简称BHT) 是一种常用的食品抗氧化剂,合成方法有如下两种,下列说法正确的是( )
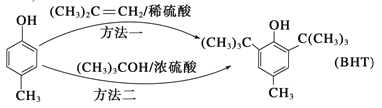
A. ![]() 不能与Na2CO3溶液反应
不能与Na2CO3溶液反应
B. ![]() 与BHT互为同系物
与BHT互为同系物
C. BHT久置于空气中不会被氧化
D. 两种方法的反应类型相同
科目:高中化学 来源: 题型:
【题目】芳香族化台物肉桂酸甲酯常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,其球棍模型如图所示(图中球与球之间的棍代表化学键,如单键、双键等)。其制备过程涉及肉桂醇电解制备肉桂醛,肉桂醛氧化制备肉非酸,再与甲醇酯化制得。下列说法不正确的是

A. 肉桂酸甲酯的分子式为C10H10O2
B. 电解肉桂醇制得的肉桂醛在电解池的阴极生成
C. 1mol肉桂酸甲酯与H2加成最多消耗4mol
D. 肉桂酸甲酯中所有碳原子可能在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向X溶液中缓慢滴加Y溶液,生成沉淀的质量如图所示,符合图像的一组是

X | Y | |
A | AlCl3、Mg(NO3)2、HNO3 | NaOH |
B | Na2CO3、NH4HCO3、Na2SO4 | Ba(OH)2 |
C | NH4NO3、Al(NO3)3、Fe(NO3)3、HCl | NaOH |
D | NaAlO2、氨水、NaOH | H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g) ![]() Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
Ni(CO)4(g),已知该反应平衡常数与温度的关系如表所示:
温度/℃ | 25 | 80 | 230 |
平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是( )
A. 上述生成Ni(CO)4(g)的反应为吸热反应
B. 25 ℃时反应Ni(CO)4(g) ![]() Ni(s)+4CO(g)的平衡常数为0.5
Ni(s)+4CO(g)的平衡常数为0.5
C. 在80 ℃时,测得某时刻,Ni(CO)4、CO浓度均0.5 mol/L,则此时v正>v逆
D. 80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式___________________________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是_______离子交换膜(填“阳”或“阴”)。阴极区的电极反应式为_____________。
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生____mol气体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是向MgCl2和AlCl3的混合溶液中加入NaOH溶液和盐酸时沉淀的物质的量y mol与加入NaOH溶液和盐酸的体积x mL的关系图,根据图示判断,下列结论中不正确的是

A. N点时溶液中的溶质只有NaCl
B. 原混合溶液中c (MgCl2)∶c (AlCl3)=1∶2
C. c (NaOH)=c (HCl)
D. M点之前加入的是NaOH溶液,M点之后加入的是盐酸
【答案】B
【解析】由图象可知N→M发生Al(OH)3+OH-===AlO2-+2H2O,设氢氧化钠溶液浓度为c,则消耗氢氧化钠0.01cmol,n[Al(OH)3]=n(AlCl3)=0.01cmol;ON消耗氢氧化钠0.05cmol,分别发生MgCl2+2NaOH=Mg(OH)2↓+2NaCl、AlCl3+3NaOH=Al(OH)3↓+3NaCl,可知n(MgCl2)=(0.05cmol-0.01c×3mol)/2=0.01cmol,则c(AlCl3):c(MgCl2)=1:1,M点时溶液成分为NaAlO2,之后继续加入溶液后沉淀质量逐渐增大,此时应加入盐酸,发生反应为:NaAlO2+HCl+H2O= Al(OH)3↓+NaCl,继续加入盐酸沉淀逐渐溶解,生成氯化镁、氯化铝和氯化钠,则消耗的氢氧化钠和HCl的物质的量相等,A.根据分析可知,N点时溶液中的溶质只有NaCl,A正确;B.原混合溶液中c(MgCl2):c(AlCl3)=1:1,B错误;C.由横坐标可知消耗盐酸和氢氧化钠的体积相同,则二者物质的量浓度相同,C正确;D.根据分析可知,M点之前加入的是NaOH溶液,M点之后加入的是盐酸,D正确;答案选B。
【题型】单选题
【结束】
16
【题目】证明某溶液中只含有Fe2+而不含有Fe3+的实验方法是
①先滴加氯水,再滴加KSCN溶液后显红色
②先滴加KSCN溶液,不显红色,再滴加氯水后显红色
③滴加NaOH溶液,先产生白色沉淀,后变灰绿,最后呈红褐色
④只需滴加KSCN溶液
A. ①② B. ②③ C. ③④ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】最近浙江大学成功研制出具有较高能量密度的新型铝一石墨烯(Cn)电池(如图)。该电池分别以铝、石墨烯为电极,放电时电池中导电离子的种类不变。已知能量密度=电池容量(J)÷负极质量(g)。下列分析正确的是
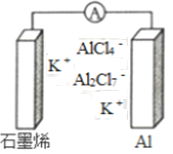
A. 放电时,Cn(石墨烯)为负极
B. 放电时,Al2Cl7-在负极转化为AlCl4-
C. 充电时,阳极反应为4 Al2Cl7-+3e-=A1+7AlCl4-
D. 以轻金属为负极有利于提高电池的能量密度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com