
【题目】氮、硫及其化合物在工农业生产生活中有着重要作用。回答下列问题:
(1)有人设想利用CO还原SO2。已知S和CO的燃烧热分别是296.0 kJ·mol1、283.0 kJ·mol1,请写出CO还原SO2的生成CO2和S(s)热化学方程式___________________________________。
(2)某科研小组研究臭氧氧化碱吸收法同时脱除SO2和NO工艺,氧化过程反应原理及反应热、活化能数据如下:
反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
NO2(g)+O2(g) △H1=-200.9 kJmol1 Ea1=3.2 kJmol1
反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
SO3(g)+O2(g) △H2=-241.6 kJmol1 Ea2=58 kJmol1
已知该体系中臭氧发生分解反应:2O3(g)![]() 3O2(g)。请回答:
3O2(g)。请回答:
其它条件不变,每次向容积为2 L的反应器中充入含2.0 mol NO、2.0 mol SO2的模拟烟气和4.0 mol O3,改变温度,反应相同时间t后体系中NO和SO2的转化率如图所示:

①由图1可知相同温度下NO的转化率远高于SO2,结合题中数据分析其可能原因_______。
②下列说法正确的是________。
A.Q点一定为平衡状态点
B.温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零
C.其它条件不变,若扩大反应器的容积可提高NO和SO2的转化率
D.臭氧氧化过程不能有效地脱除SO2,但后续步骤碱吸收可以有效脱硫
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,则体系中剩余O3的物质的量是________mol;SO2的平均反应速率为________;反应Ⅰ在此时的平衡常数为_______________。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

①ab是_______离子交换膜(填“阳”或“阴”)。阴极区的电极反应式为_____________。
②若NO吸收转化后的产物为NH4+,通电过程中吸收4.48LNO(标况下),则阳极可以产生____mol气体。
【答案】 2CO(g)+SO2(g)=2CO2(g)+S(s) ΔH=-270 kJ·mol1 反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应 BD 1.4 0.06mol/(L·min) 8 阳 2SO32+4H++2e=S2O42+2H2O 0.25
【解析】分析:(1)利用燃烧热借助于盖斯定律解答;
(2)①根据活化能对反应速率的影响分析;
②根据反应原理结合图像曲线变化分析判断;
③根据方程式结合有关概念计算;
(3)①根据电解产物结合离子的移动方向判断;
②根据电子得失守恒计算。
详解:(1)已知S和CO的燃烧热分别是296.0kJ·mol-1、283.0kJ·mol-1,则
①S(s)+O2(g)=SO2(g)ΔH=-296.0kJ·mol-1
②CO(g)+1/2O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
根据盖斯定律可知②×2-①即得到CO还原SO2的热化学方程式2CO(g)+SO2(g)=2CO2(g)+S(s)ΔH=-270kJ·mol-1。
(2)①反应Ⅰ的活化能小于反应Ⅱ,相同条件下更易发生反应,因此相同温度下NO的转化率远高于SO2;
②A.随着反应的进行,反应物的转化率逐渐增大,因此Q点不一定为平衡状态点,可能是建立平衡过程中的一个点,A错误;B.根据图像,温度高于200℃后,NO和SO2的转化率随温度升高显著下降、最后几乎为零,B正确;C.根据2O3(g)![]() 3O2(g)可知其它条件不变,若扩大反应器的容积,压强减小,平衡正向移动,使得臭氧的浓度减小,氧气浓度增大,反应I和反应II的平衡逆向移动,NO和SO2的转化率减小,C错误;D.根据图像,臭氧氧化过程中二氧化硫的转化率较低,不能有效地脱除SO2,二氧化硫是碱性氧化物,能够被氢氧化钠溶液吸收,D正确;答案选BD;
3O2(g)可知其它条件不变,若扩大反应器的容积,压强减小,平衡正向移动,使得臭氧的浓度减小,氧气浓度增大,反应I和反应II的平衡逆向移动,NO和SO2的转化率减小,C错误;D.根据图像,臭氧氧化过程中二氧化硫的转化率较低,不能有效地脱除SO2,二氧化硫是碱性氧化物,能够被氢氧化钠溶液吸收,D正确;答案选BD;
③假设100℃时P、Q均为平衡点,此时反应时间为5min,发生分解反应的臭氧占充入臭氧总量的10%,发生分解反应的臭氧为4mol×10%=0.4mol,根据反应Ⅰ:NO(g)+O3(g)![]() NO2(g)+O2(g),平衡时NO的转化率为80%,反应的臭氧为2mol×80%=1.6mol;反应Ⅱ:SO2(g)+O3(g)
NO2(g)+O2(g),平衡时NO的转化率为80%,反应的臭氧为2mol×80%=1.6mol;反应Ⅱ:SO2(g)+O3(g)![]() SO3(g)+O2(g),平衡时二氧化硫的转化率为30%,反应的臭氧为2mol×30%=0.60mol;最终剩余臭氧4mol-0.4mol-1.60mol-0.60mol=1.4mol;5min内SO2的平均反应速率=
SO3(g)+O2(g),平衡时二氧化硫的转化率为30%,反应的臭氧为2mol×30%=0.60mol;最终剩余臭氧4mol-0.4mol-1.60mol-0.60mol=1.4mol;5min内SO2的平均反应速率=![]() =0.06mol/(L·min);平衡时NO、O3、NO2、O2的物质的量分别为0.4mol、1.4mol、1.6mol、0.4mol×
=0.06mol/(L·min);平衡时NO、O3、NO2、O2的物质的量分别为0.4mol、1.4mol、1.6mol、0.4mol×![]() +1.6mol+0.6mol=2.8mol,反应Ⅰ在此时的平衡常数=
+1.6mol+0.6mol=2.8mol,反应Ⅰ在此时的平衡常数=![]() =8;
=8;
(3)①由图可知,阴极区通入液体主要含SO32-,流出主要含S2O42-,所以阴极区电极反应式为2SO32-+4H++2e-=S2O42-+2H2O,由于阴极需要消耗氢离子,则ab是阳离子交换膜;②4.48LNO(标况下)的物质的量是0.2mol,由于NO吸收转化后的产物为NH4+,则电路中转移1mol电子;阳极氢氧根放电产生氧气,需要氧气的物质的量是1mol÷4=0.25mol。


科目:高中化学 来源: 题型:
【题目】在强酸性溶液中能大量共存且溶液为无色透明的离子组是
A.Ag+、NO3–、Cl–、K+B.Ca2+、Na+、Fe3+、NO3–
C.K+、Cl–、HCO3–、NO3–D.Mg2+、Cl–、Al3+、SO42–
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将250mL含BaCl2和KCl的混合溶液分成5等份,取一份加入含a mol硫酸钠的溶液,恰好使钡离子完全沉淀;另取一份加入含b mol硝酸银的溶液,恰好使氯离子完全沉淀。则原混合溶液中钾离子物质的量浓度为
A. 4(b-2a)mol/L B. 20(2a-b)mol/L
C. 20(b-2a)mol/L D. 10(b-a)mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,食品安全事故频繁发生,人们对食品添加剂的认识逐渐加深。Butylated Hydroxy Toluene(简称BHT) 是一种常用的食品抗氧化剂,合成方法有如下两种,下列说法正确的是( )
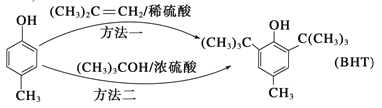
A. ![]() 不能与Na2CO3溶液反应
不能与Na2CO3溶液反应
B. ![]() 与BHT互为同系物
与BHT互为同系物
C. BHT久置于空气中不会被氧化
D. 两种方法的反应类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别向体积相同、浓度均为0.1 mol/L的MOH、ROH两种碱溶液中不断加水稀释,溶液的pH与溶液浓度的对数(lgc)间的关系如图。下列说法错误的是

A. Kb(MOH)的数量级为10-5
B. a、b两点溶液中,水的电离程度:a<b
C. 等体积等浓度的ROH和MCl混合后所得溶液中:c(OH-)>c(H+)
D. 用相同浓度的盐酸分别中和a、b两点溶液,消耗盐酸体积:Va>Vb
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)是肉制品生产中最常使用的一种食品添加剂,某化学兴趣小组利用一氧化氮与过氧化钠反应制备亚硝酸钠并进行一系列实验探究。
查阅资料:
①NO2能与Na2O2反应;
②在酸性溶液中,NO2-可将MnO4-还原为Mn2+且无气体生成。
③NO不与碱反应,可被酸性KMnO4溶液氧化为硝酸。
Ⅰ.制备亚硝酸钠

(1)装置A用恒压滴液漏斗,相比普通分液漏斗,显著的优点是____________________________。
(2)上述装置按气流方向连接的顺序为:a→____________________(填仪器接口的字母编号)。
(3)D中反应的方程式为_____________________________。如果没有B装置,D中生成的亚硝酸钠中含有的杂质有______________(填化学式)。
(4)C装置的作用是_________________(用离子方程式表示)。
Ⅱ.测定产品纯度,实验步骤:
①准确称量4.000 g产品配成250 mL溶液。
②从步骤①配制的溶液中移取25.00 mL加入锥形瓶中。
③用0.1000 mol/L酸性KMnO4溶液滴定至终点。
④重复以上操作3次,消耗酸性KMnO4溶液的平均体积为20.00 mL。
(5)达到滴定终点的现象是____________。产品中NaNO2的纯度为______________%。
(6)设计实验证明HNO2的酸性比CH3COOH强_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是(NA表示阿伏加德罗常数的值)( )
A.等物质的量的N2和CO所含分子数均为NA
B.物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl-的个数为NA
C.1mol OH- 和17g NH3 所含的电子数相等
D.在常温常压下,11.2 L N2 所含有的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,不正确的是( )
A.光导纤维是以二氧化硅为主要原料制成的
B.二氧化硅溶于水生成硅酸
C.石英、水晶、玛瑙的主要成分都是二氧化硅
D.二氧化硅是一种熔沸点很高、硬度很大的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1 mol过氧化钠与2 mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是( )
A. Na2CO3 B. Na2O2、Na2CO3
C. NaOH、Na2CO3 D. Na2O2、NaOH、Na2CO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com