
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
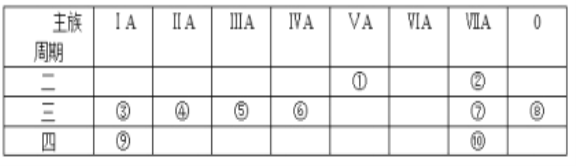
(1)在③~⑦元素中,原子半径最大的元素是________,其离子结构示意图为________
(2)元素的最高价氧化物对应的水化物中酸性最强的物质是________,碱性最强的物质是_______,呈两性的氢氧化物是________;
(3)按要求写出下列两种物质的电子式:①的氢化物________;⑨的最高价氧化物对应的水化物________;
(4)在⑦与⑩的单质中,化学性质较活泼的是_______,可用什么化学反应说明该事实(写出反应的化学方程式):_____________.
【答案】Na 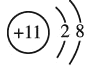 HClO4 KOH Al(OH)3
HClO4 KOH Al(OH)3 ![]()
![]() Cl2 2NaBr+Cl2=2NaCl+Br2
Cl2 2NaBr+Cl2=2NaCl+Br2
【解析】
根据元素的周期数和族序数,可以判断①是N,②是F,③是Na,④是Mg,⑤是Al,⑥是Si,⑦是Cl,⑧是Ar,⑨是K,⑩是Br。
(1)同周期元素从左到右,原子半径逐渐减小,在③~⑦元素中,原子半径最大的是Na;其离子为Na+,与钠原子比较少了一个电子,Na+的结构示意图为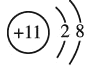 ;
;
(2)周期表中,从上到下,元素的最高价氧化物对应水化物的碱性逐渐增强,酸性逐渐减弱,从左到右,元素的最高价氧化物对应水化物的酸性逐渐增强,碱性逐渐减弱,在这些元素的最高价氧化物对应水化物中,酸性最强的是HClO4,碱性最强的物质是KOH,呈两性的氢氧化物是Al(OH)3;
(3)①的氢化物NH3,电子式为![]() ;⑨的最高价氧化物的对应的水化物是KOH,钾离子电子式K+,氢氧根电子式为
;⑨的最高价氧化物的对应的水化物是KOH,钾离子电子式K+,氢氧根电子式为![]() ,KOH的电子式为
,KOH的电子式为![]() ;
;
(4)同主族元素,从上到下,单质的氧化性逐渐减弱,所以在氯气和溴的单质中,化学性质较为活泼的是氯气,因为氯气可以与溴化钾反应,置换出单质溴,答案:Cl2,2NaBr+Cl2=2NaCl+Br2。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】某待测溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。下列说法不正确的是
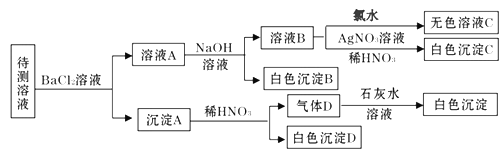
A. SO42-、SO32-至少含有一种
B. 沉淀B的化学式为 BaCO3
C. 肯定存在的离子有 Na+、CO32-、HCO3-、Cl-
D. 肯定不存在Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通过氮气和氢气反应合成氨,氨经一系列反应可以得到硝酸。反应历程如下图所示,下列说法不正确的是( )
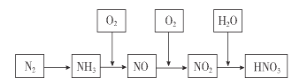
A. 氨可用作制冷剂
B. 铵态氮肥一般不能与碱性化肥共同使用
C. 硝酸可用于制化肥、农药、炸药、染料、盐类等
D. 某浓硝酸中含有溶质2mol,标准状况下,该浓硝酸与足量的铜完全反应能生成1mol![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有些垃圾可以用卫生填埋、焚烧、堆肥等方法处理。下列垃圾中,不适合用这样的方法处理的是( )
A.农作物垃圾,如秸秆等B.电池C.纸品D.纯棉纺织品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列化学反应的离子方程式是( )
A. 碳酸钙与醋酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
B. 氯气溶于水:Cl2+H2O![]() 2H+ +Cl一+ClO一
2H+ +Cl一+ClO一
C. 过量二氧化碳与石灰水反应:CO2+2OH一=CO32一+H2O
D. 利用腐蚀法制作印刷线路板:2Fe3+ +Cu=2Fe2+ +Cu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组为了深入探究二氧化硫的性质设计以下装置进行了实验。

步骤一:检验装置气密性后向B、C中各加入20mL图示液体。
步骤二:打开A中活塞,反应进行10分钟后关闭活塞。
步骤三:用pH计分别测量B、C试管中溶液的pH。
结合上述实验,回答以下问题:
请回答下列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是________,其中发生反应的化学方程式为_______________________。
(2)甲同学认为两瓶中pH大致相等,原因是二氧化硫溶于水后生成了酸性物质_____________,该物质发生电离所致。
(3)通过pH计测定,B瓶中pH为2.13,C瓶中pH为1.05。为了解释该实验现象,该同学提出进行多次平行实验,目的是_______________________。
测定结果如下:
第1次实验 | 第2次实验 | 第3次实验 | |
B瓶中pH | 2.15 | 2.10 | 2.17 |
C瓶中pH | 1.10 | 1.12 | 1.09 |
实验发现:C瓶中溶液的酸性始终比B瓶中的酸性强。
(4)通过查阅文献,I﹣可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程分两步进行如下,将ii补充完整。
i.SO2+4I﹣+4H+=S↓+2I2+2H2O
ii.I2+2H2O+___═___+___+2I﹣
(5)最终结论:C瓶中溶液酸性强于B瓶,是由于生成了____________,该过程中体现出二氧化硫哪些化学性质________________(选填“氧化性”,“还原性”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g)K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
COS(g)+H2(g)K=0.1,反应前CO物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是
A. 升高温度,H2S浓度增加,表明该反应是吸热反应 B. CO的平衡转化率为80%
C. 反应前H2S物质的量为7mol D. 通入CO后,正反应速率逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com