
【题目】某待测溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。下列说法不正确的是
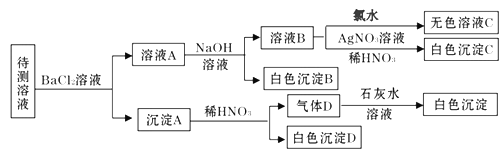
A. SO42-、SO32-至少含有一种
B. 沉淀B的化学式为 BaCO3
C. 肯定存在的离子有 Na+、CO32-、HCO3-、Cl-
D. 肯定不存在Br—
【答案】C
【解析】
待测液与氯化钡溶液反应生成沉淀A,则溶液中可能含有CO32-、SO42-、或SO32-,向沉淀A中加入稀硝酸生成气体D,气体D与石灰水作用产生白色沉淀,且有部分沉淀不溶解,则溶液中一定存在CO32-,可能存在SO42-、SO32-中的两种或一种;加入的氯化钡过量,所以溶液A中有Ba2+、Cl-,溶液A中加入过量的NaOH溶液得到白色沉淀B,则溶液中一定含有HC03-,白色沉淀B为BaCO3;溶液B中通入氯气,得无色溶液,溶液中一定不存在Br-;溶液B中加入硝酸酸化的硝酸银溶液得到白色沉淀,白色沉淀为AgCl,说明溶液B中含有C1-,由于开始时加入了氯化钡溶液,不能确定原溶液中是否含有Cl-。
A.根据以上分析可知,待测液中至少存在SO42-、SO32-中的一种,故A正确;B.根据分析可知,沉淀B为BaCO3,HCO3-与Ba2+、OH-反应生成的BaC03,故B正确;C.根据分析可知不能确定待测液中是否存在Cl-,故C错误;D.根据分析可知待测液中一定不存在Br-的离子,故D正确。答案:C。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】氨是化学实验室及化工生产中的重要物质,应用广泛。
(1)已知25℃时:N2(g)+O2(g)![]() 2NO(g) ΔH=+183 kJ/mol
2NO(g) ΔH=+183 kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ/mol
4NH3(g)+5O2(g)=4NO(g)+6H2O(l) ΔH=-1164.4 kJ/mol
则N2(g)+3H2(g)![]() 2NH3(g) ΔH=______kJ/mol
2NH3(g) ΔH=______kJ/mol
(2)在恒温恒容密闭容器中进行合成氨反应,起始投料时各物质浓度如下表:
N2 | H2 | NH3 | |
投料Ⅰ | 1.0 mol/L | 3.0 mol /L | 0 |
投料Ⅱ | 0.5 mol/L | 1.5 mol/L | 1.0 mol/L |
①按投料Ⅰ进行反应,测得达到化学平衡状态时H2的转化率为40%,则该温度下合成氨反应的平衡常数表达式为_______。
②按投料Ⅱ进行反应,起始时反应进行的方向为________(填“正向”或“逆向”)。
③若升高温度,则合成氨反应的化学平衡常数________(填“变大”、“变小”或“不变”)。
④L(L1、L2)、X可分别代表压强或温度。下图表示L一定时,合成氨反应中H2(g)的平衡转化率随X的变化关系。

ⅰ X代表的物理量是______。
ⅱ 判断L1、L2的大小关系,并简述理由______。
(3)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下:
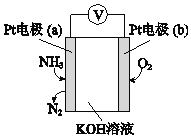
①电极b上发生的是______反应(填“氧化”或“还原”)。
②写出电极a的电极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
实验编号 | 0.1mol/L酸性KMnO4溶液的体积/mL | 0.6mol/LH2C2O4溶液的体积/mL | H2O的体积/mL | 实验温度/℃ | 溶液褪色所需时间/min |
① | 10 | V1 | 35 | 25 | |
② | 10 | 10 | 30 | 25 | |
③ | 10 | 10 | V2 | 50 |
(1)表中V1=_______mL,V2=_______mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是________。
(3)实验①测得KMnO4溶液的褪色时间为2min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________mol·L-1·min-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把在空气中久置的铝片5.0g投入盛有500mL 0.5molL﹣1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:

(1)曲线由O→a段不产生氢气的原因是_____________________;有关反应的离子方程式为________________________;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因________________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,正逆反应速率为零
B. 若单位时间内生成xmol NO的同时,生成xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2υ(NH3)=3υ(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,水存在H2O![]() H++OH--Q的平衡,下列叙述一定正确的是
H++OH--Q的平衡,下列叙述一定正确的是
A. 向水中滴入少量稀盐酸,平衡逆向移动,Kw减小
B. 将水加热,Kw增大,pH减小
C. 向水中加入少量固体CH3COONa,平衡逆向移动,c(H+)降低
D. 向水中加入少量固体NH4Cl,c(H+)=10-7mol/L,Kw不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香化合物A是一种基本化工原料,可以从煤和石油中得到。A、B、C、D、E的转化关系如图所示:
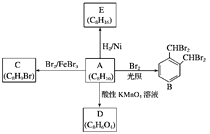
回答下列问题:
(1)A的化学名称是________;E属于________(填“饱和烃”或“不饱和烃”)。
(2)A→B的反应类型是__________,在该反应的副产物中,与B互为同分异构体的副产物的结构简式为________________。
(3)A→C的化学方程式为________________________________________________。
(4)A与酸性KMnO4溶液反应可得到D,写出D的结构简式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)化合物A可由环戊烷经三步反应合成:
![]() 。
。
已知:![]() 。
。
反应1的试剂与条件为________;反应2的化学方程式为____________。
(2)下面是以环戊烷为原料制备环戊二烯的合成路线:
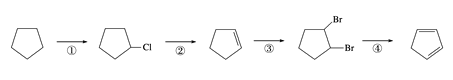 。
。
其中,反应①的产物名称是____________,反应②的反应试剂和反应条件是________________,反应③的反应类型是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
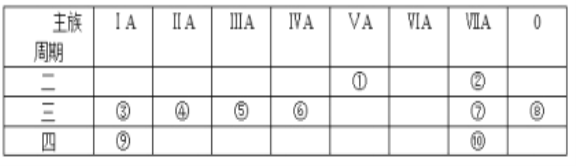
(1)在③~⑦元素中,原子半径最大的元素是________,其离子结构示意图为________
(2)元素的最高价氧化物对应的水化物中酸性最强的物质是________,碱性最强的物质是_______,呈两性的氢氧化物是________;
(3)按要求写出下列两种物质的电子式:①的氢化物________;⑨的最高价氧化物对应的水化物________;
(4)在⑦与⑩的单质中,化学性质较活泼的是_______,可用什么化学反应说明该事实(写出反应的化学方程式):_____________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com