
【题目】对可逆反应4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是
A. 达到化学平衡时,正逆反应速率为零
B. 若单位时间内生成xmol NO的同时,生成xmol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增大容器容积,则正反应速率减小,逆反应速率增大
D. 化学反应速率关系:2υ(NH3)=3υ(H2O)
科目:高中化学 来源: 题型:
【题目】党的十九大报告中提出要建设美丽中国,推进绿色发展。燃煤烟气(污染气体包括NOx、CO、SO2等)的综合治理是解决大气污染的主要途径。
(1)用CH4催化还原氮氧化物可以消除其污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=-574kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=-1160kJ·mol-1
③H2O(g)=H2O(1)△H=-44.0kJ·mol-1
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式__________。
(2)选择合适的催化剂,在一定条件下可对部分燃煤烟气回收,其主要反应是:2CO(g)+SO2(g)![]() 2CO2(g)+S(1)△H=-270kJ·mol-1
2CO2(g)+S(1)△H=-270kJ·mol-1
①其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图1,Fe2O3和NiO作催化剂均能使SO2的转化率达到最高,不考虑催化剂价格因素,选择Fe2O3的主要优点是__________。
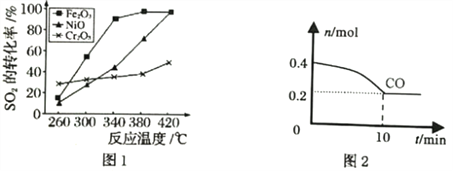
②T℃Fe2O3催化作用下,将等物质的量的CO和SO2充入容积为2L的密闭容器中,保持温度和体积不变,反应过程中CO的物质的量随时间变化如图2所示。10min内该反应的速率v(SO2)=________;T℃时该化学反应的平衡常数K=______;保持容积固定,若升高温度,反应的平衡常数_________(填“增大”“减小”或“不变”,下同),容器内混合气体的密度__________。
(3) 图3是用食盐水做电解液电解烟气脱氮的原理图,NO被阳极产生的氧化性物质氧化为NO3-,尾气经NaOH溶液吸收排入空气。
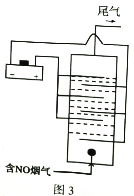
①NO被氧化的离子方程式是__________。
②若通入的烟气2240L(标准状况),烟气中NO含量为15%,(假设烟气中无其他含氮气体),测得溶液中含有NO3-的物质的量为1.47mol,则NO除去率为__________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3+5O2![]() 4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)[(mol / (L·min)]表示,则正确的关系是( )
4NO+6H2O,若反应速率分别用υ(NH3)、υ(O2)、υ(NO)、υ(H2O)[(mol / (L·min)]表示,则正确的关系是( )
A. 4υ(NH3)=5υ(O2) B. 5υ(O2)=6υ(H2O)
C. 4υ(O2)=5υ(NO) D. 2υ(NH3)=3υ(H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钼(Mo)是一种难熔稀有金属,我国的钼储量居世界第二。钼及其合金在冶金,农业、电器、化工、环保等方面有着广泛的应用。
(1)Mo可被发烟硝酸氧化,产物MoOF4和MoO2F2物质的量比为1∶1,完成下列方程式:____Mo+____HF+____HNO3=____ MoO2F2+____ MoOF4+____NO2↑+____ _________
(2)已知:①2Mo(s)+3O2(g)=2MoO3(s) ΔH1
②MoS2(s) +2O2(g)=Mo(s)+2SO2(g) ΔH2
③2MoS2(s)+7O2(g)=2MoO3(s)+4SO2(g) ΔH3
则ΔH3 =_________(用含ΔH1、ΔH2的代数式表示),在反应③中若有0.2mol MoS2参加反应,则转移电子_______________mol。
(3)密闭容器中用Na2CO3(S)作固硫剂,同时用一定量的氢气还原辉钼矿(MoS2)的原理是:MoS2(s)+4H2(g)+2Na2CO3(s)![]() Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:
Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) ΔH,实验测得平衡时的有关变化曲线如图所示:

①由图可知,该反应的ΔH__0(填“>”或“<”);P2__________0.1MPa(填“>”或“<”)。
②如果上述反应在体积不变的密闭容器中达平衡,下列说法错误的是______(选填编号)。
A.v正(H2)=v逆(H2O)
B.再加入MoS2,则H2转化率增大
C.容器内气体的密度不变时,一定达平衡状态
D.容器内压强不变时,一定达平衡状态
③由图可知M点时氢气的平衡转化率为____(计算结果保留0.1%)。
④平衡常数可用平衡分压代替平衡浓度计算,气体分压=气体总压×物质的量分数。求图中M点的平衡常数Kp=______(MPa)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中,由CO2和H2合成甲醇,CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);
CH3OH(g)+H2O(g),在其他条件不变的情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);

(1)下列说法正确的是_____________________(填序号);
①温度为T1时,从反应平衡,生成甲醇的平均速率为v(CH3OH)=![]() mol·L-1·min-1
mol·L-1·min-1
②该反应为放热反应
③处于A点的反应体系从T1变到T2,达到平衡时![]() 增大
增大
(2)在T1温度时,将1 mol CO2和3 mol H2充入一密闭恒容容器中,充分反应达到平衡后,若CO2的转化率为α,则容器内的压强与起始压强之比为_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液中可能含有Na+、SO42-、SO32-、Cl-、Br-、CO32-、HCO3-中的一种或多种,进行如下图所示的实验,每次实验所加试剂均过量。下列说法不正确的是
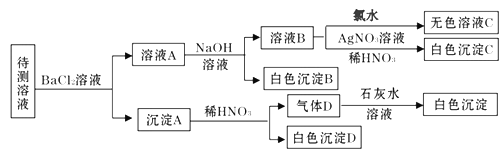
A. SO42-、SO32-至少含有一种
B. 沉淀B的化学式为 BaCO3
C. 肯定存在的离子有 Na+、CO32-、HCO3-、Cl-
D. 肯定不存在Br—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是( )
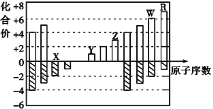
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1∶1和1∶2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物结构简式为 ,下列叙述不正确的是( )
,下列叙述不正确的是( )
A. 1 mol 该有机物在加热和催化剂作用下,最多能和4 mol H2反应
B. 该有机物能使溴水褪色,也能使酸性KMnO4溶液褪色
C. 该有机物遇硝酸银溶液产生白色沉淀
D. 该有机物在一定条件下能发生消去反应或取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A. 试剂X可以是氢氧化钠溶液,也可以是盐酸
B. 反应①过滤后所得沉淀为氢氧化铁
C. 电解法制取铝单质时也可以采用电解氯化铝以降低成本
D. 反应②的化学方程式为NaAlO2+CO2+2H2O===Al(OH)3↓+NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com