
| A、16 g O2与O3混合物中所含电子数为8NA |
| B、标准状况下,2.24 L CH3OH分子中共用电子对数为0.5NA |
| C、6 g SiO2晶体中硅氧共价键数为0.4NA |
| D、0.1 mol 13C18O中所含中子数为1.7NA |
| m |
| M |
| 16g |
| 16g/mol |
| m |
| M |
| 6g |
| 60g/mol |


 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 )作用生成腥红色配合物沉淀A.
)作用生成腥红色配合物沉淀A.查看答案和解析>>
科目:高中化学 来源: 题型:
| X | |||
| W | Y |
| Y的氢化物 | 一元酸HA |
| Ka1=9.1×10-8,Ka2=1.1×10-12 | Ka=1.1×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
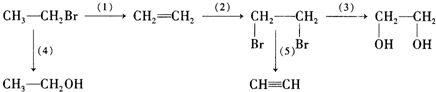
查看答案和解析>>
科目:高中化学 来源: 题型:

 ”表示硝基、用“…”表示氢键,画出C2分子的结构
”表示硝基、用“…”表示氢键,画出C2分子的结构 和
和  ,写出另3种同分异构体的结构简式
,写出另3种同分异构体的结构简式查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com