
����Ŀ����ҵ�Ͽ�����CO2���Ʊ����Һ�����ϼ״����йػ�ѧ��Ӧ���£�
��Ӧ��CO2��g��+3H2��g��CH3OH��g��+H2O��g�� ��H1����49.6kJmol-1
��Ӧ��CO2��g��+H2��g��H2O��g��+CO��g�� ��H2��+41kJmol-1
��1����Ӧ����___�������������������������¿��Է���Ӧ��
��2�����������������Ӧ�״�ƽ����ʵ�������___��
A�����¸�ѹ B�����µ�ѹ C�����µ�ѹ D�����¸�ѹ
��3����Cu��ZnO/ZrO2���£�CO2��H2������壬�����1��3�������ʵ���amol���з�Ӧ�����CO2ת���ʡ�CH3OH��COѡ�������¶ȡ�ѹǿ�仯����ֱ���ͼ��ʾ��ѡ���ԣ�ת����CO2������CH3OH��CO�İٷֱȣ���

������˵����ȷ����___��
A��ѹǿ��Ӱ������ѡ����
B��CO2ƽ��ת�������¶�������������С
C����ͼ1��֪����Ӧ������¶�Ϊ220������
D����ʱ������״���ˮ�Լ�ʹ�����Ͷ�����̼ѭ��ʹ�ã������ԭ��������
��250��ʱ����Ӧ��͢�ﵽƽ�⣬ƽ��ʱ�������ΪVL��CO2ת����Ϊ25%��CH3OH��COѡ���Ծ�Ϊ50%������¶��·�Ӧ���ƽ�ⳣ��Ϊ___��
�۷���ͼ2��COѡ�����½���ԭ��___��
���𰸡����� D ACD ![]() ����ѹǿ�������ڷ�Ӧ��ƽ�������ƶ���ʹ��Ӧ��Ũ�ȼ�С���Ӷ�ʹ��Ӧ�������ƶ���COѡ�����½�
����ѹǿ�������ڷ�Ӧ��ƽ�������ƶ���ʹ��Ӧ��Ũ�ȼ�С���Ӷ�ʹ��Ӧ�������ƶ���COѡ�����½�
��������
���ݼ���˹�������жϷ�Ӧ�Է����е�����������ƽ���ƶ�ԭ��������𣻸���ת���ʡ�ƽ�ⳣ���ı���ʽ�������
��1�����ڷ�ӦCO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��49.6kJmol��1����H��0����S��0�����練Ӧ���Է����У�Ӧ�����H��T��S��0�������¼��ɽ��У��ʴ�Ϊ�����£�
��2����ӦCO2��g��+3H2��g��CH3OH��g��+H2O��g����H1=��49.6kJmol��1���ɻ�ѧ��������֪������ѹǿ��ƽ�������ƶ���������ӦΪ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ�������¸�ѹ��������״��IJ��ʣ��ʴ�Ϊ��D��
��3����A.����ѹǿ����Ӧ�������ƶ����״��IJ�������˵��ѹǿӰ������ѡ���ԣ���A��ȷ��
B.��Ӧ��Ϊ���ȷ�Ӧ�������¶ȣ�ƽ�������ƶ���������̼��ƽ��ת���ʼ�С����B����
C.��ͼ1��֪����Ӧ���¶ȿ�����220������ʱ��������̼��ת���ʡ��״��ĺ����ϴ�CO�ĺ�����С�����ߵ�240���Ժ״���ѡ���Լ�С����Ӧ������¶�Ϊ220�����ң���C��ȷ��
D.��ʱ������״���ˮ����ʹƽ�������ƶ�����ѭ��ʹ�������Ͷ�����̼�����ṩԭ�ϵ������ʣ���D��ȷ���ʴ�Ϊ��ACD��
����Cu��ZnO/ZrO2���£�CO2��H2������壬�����1��3�������ʵ���amol���з�Ӧ��
250��ʱ����Ӧ��͢�ﵽƽ�⣬ƽ��ʱ�������ΪVL��CO2ת����Ϊ25%��CH3OH��COѡ���Ծ�Ϊ50%���ɷ���ʽ��֪������n��CO2��=![]() ��25%mol=
��25%mol=![]() mol������CH3OH��CO��
mol������CH3OH��CO��![]() mol���ֱ�Ϊ
mol���ֱ�Ϊ![]() mol������n��H2O��=
mol������n��H2O��=![]() mol��������Ӧ�������������ʵ���Ϊ
mol��������Ӧ�������������ʵ���Ϊ![]() mol��3+
mol��3+![]() mol=
mol=![]() mol����ʣ�����������ʵ���Ϊ
mol����ʣ�����������ʵ���Ϊ![]() mol��
mol��![]() mol=
mol=![]() mol��
mol��![]() ����Ӧ���ƽ�ⳣ��
����Ӧ���ƽ�ⳣ��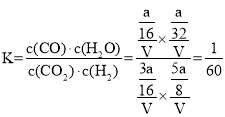 ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��
�۶��ڷ�Ӧ������ѹǿƽ�ⲻ�ƶ�������Ӧ��Ӧ������ѹǿ��ƽ�������ƶ������·�Ӧ���Ũ�Ƚ��ͣ�����ˮ��Ũ���������·�Ӧ��ƽ�������ƶ���CO��ѡ�����½����ʴ�Ϊ������ѹǿ�������ڷ�Ӧ��ƽ�������ƶ���ʹ��Ӧ��Ũ�ȼ�С���Ӷ�ʹ��Ӧ�������ƶ���COѡ�����½���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��298Kʱ,��20mL0.1mol��L-1MOH��Һ�еμ�0.1mol��L-1CH3COOH��Һ,������Һ��pH�����������仯��ͼ��ʾ������������ȷ������ ��
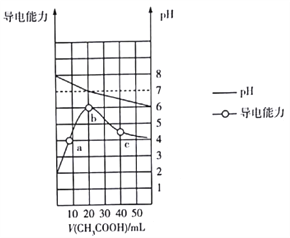
A. MOH��ǿ����� B. b���Ӧ���β�ˮ��
C. ˮ�����ӻ�Kw��b>c>a D. c����Һ��c(CH3COO-)>c(M+)>c(H+)>c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����жԻ�ѧƽ���ƶ��ķ����У�����ȷ����
���Ѵ�ƽ��ķ�ӦC(s)��H2O(g)![]() CO(g)��H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ������Ѵ�ƽ��ķ�ӦN2(g)��3H2(g)
CO(g)��H2(g)�������ӷ�Ӧ�����ʵ���ʱ��ƽ��һ��������Ӧ�����ƶ������Ѵ�ƽ��ķ�ӦN2(g)��3H2(g)![]() 2NH3(g)��������N2��Ũ��ʱ��ƽ��������Ӧ�����ƶ���N2��ת����һ������ ��������μӵķ�Ӧ�ﵽƽ��ʱ������С��Ӧ���ݻ�ʱ��ƽ��һ���������������ķ����ƶ�����������μӵķ�Ӧ��ƽ��ʱ���ں�ѹ��Ӧ���г���ϡ�����壬ƽ��һ�����ƶ�
2NH3(g)��������N2��Ũ��ʱ��ƽ��������Ӧ�����ƶ���N2��ת����һ������ ��������μӵķ�Ӧ�ﵽƽ��ʱ������С��Ӧ���ݻ�ʱ��ƽ��һ���������������ķ����ƶ�����������μӵķ�Ӧ��ƽ��ʱ���ں�ѹ��Ӧ���г���ϡ�����壬ƽ��һ�����ƶ�
A.�٢�B.�٢ڢ�C.�ڢۢ�D.�٢ڢۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ�����͵���ɫ��Դ������һ����Ҫ�Ļ���ԭ�ϡ����������(��C��)��ˮ������Ӧ��ȡH2��һ�ֵͺ��ܣ���Ч�ʵ���H2�������÷���������¯����H2��ȼ��¯����CaO�������ɡ�����¯���漰�ķ�Ӧ�У�
��.C(s)��H2O(g)![]() CO(g)��H2(g) K1��
CO(g)��H2(g) K1��
��.CO(g)��H2O(g)![]() CO2(g)��H2(g) K2��
CO2(g)��H2(g) K2��
��.CaO(s)��CO2(g)![]() CaCO3(s) K3��
CaCO3(s) K3��
ȼ��¯���漰�ķ�ӦΪ��
��.C(s)��O2(g)=CO2��
��.CaCO3(s)=CaO(s)��CO2(g)��
��1�����ܱ���Ϊ��߷�չDZ������ɫ��Դ���ù�����H2�ܷ�Ӧ�ɱ�ʾΪC(s)��2H2O(g)��CaO(s)![]() CaCO3(s)��2H2(g)���䷴Ӧ��ƽ�ⳣ��K=____(��K1��K2��K3�Ĵ���ʽ��ʾ)��
CaCO3(s)��2H2(g)���䷴Ӧ��ƽ�ⳣ��K=____(��K1��K2��K3�Ĵ���ʽ��ʾ)��
��2����һ�ݻ��ɱ���ܱ������н��з�Ӧ���º�ѹ�����£������м���1.0mol̿��1.0molˮ�������ﵽƽ��ʱ�������������Ϊԭ����1.25����ƽ��ʱˮ������ƽ��ת����Ϊ_____����������в���amol̿��ˮ������ת���ʽ�_____������������������С����������������
��3�����ڷ�Ӧ����ƽ��ʱ�ٳ���CO2��ʹ��Ũ������ԭ����2������ƽ��_____�ƶ�( ����������������������������)��������ƽ���CO2Ũ��___(���������������С������������)��
��4��һ����������Ӷ��ε�������������(LiFePO4)��ء���Ϊ�������ϵ���������ڳ䡢�ŵ�ʱ�ľֲ��Ŵ�ʾ��ͼ��ͼ��д���õ�س��ʱ�������缫��Ӧʽ��______��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����е����Ų�ͼ����ʾ��Ԫ��ԭ���У��������������״̬���� (����)

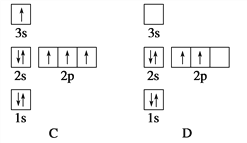
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ʊ��������ԭ��Ϊ��3![]() +8KMnO4�T3KOOC��CH2��4COOK+8MnO2��+2KOH+5H2O
+8KMnO4�T3KOOC��CH2��4COOK+8MnO2��+2KOH+5H2O
��Ҫʵ��װ�úͲ������£�
������ͼװ���м���5mL10%����������Һ��50mLˮ������ʹ���ܽ⣬Ȼ�����6.3g������أ�С��Ԥ����Һ��40�档
�ڴӺ�ѹ©���л����μ�1.4mL�����������Ƶ��٣�ʹ��Ӧ�¶�ά����45�����ң���Ӧ20min�����ڷ�ˮԡ�ϼ���5min��ʹ��Ӧ��ȫ��ʹMnO2�������ۡ�
�ۼ����������������ƹ����ȥ���������ء�
��ͨ��___�������õ���������Һ��ϴ�ӳ���2��3�Σ���ϴ��Һ�ϲ�����Һ��
�ݼ���Ũ��ʹ��Һ���������10mL���ң�����С�ļ���Ũ���ᣬʹ��Һ��ǿ���ԣ�����pH��1��2������ȴ�ᾧ�����ˡ�ϴ�ӡ�����ü������ɫ����1.5g��

��֪��������ĵ���ƽ�ⳣ����Ka1��3.8��10��5��Ka2��3.9��10-6����Է�������Ϊ146������ˮ���ܽ�����±�
�¶ȣ��棩 | 15 | 34 | 50 | 70 | 87 | 100 |
�������ܽ�ȣ�g�� | 1.44 | 3.08 | 8.46 | 34.1 | 94.8 | 100 |
��1��������л����μӻ�������ԭ����___��
��2������ܻ��߲��ֲ�����___���ڵڢܡ��ݲ��о�Ҫ��ϴ�ӳ���������ϴ��Һ����Ϊ___��___��
��3������ݼ���Ũ�������pH��ǿ���Ե�ԭ����___��
��4���������Ʒ�Ĵ��ȿ������ζ����ⶨ��ȡ������ag��ȷ��0.0001g��������250mL��ƿ�У�����50mL��ȥCO2��������ˮ��ҡ��ʹ������ȫ�ܽ⣬��ȴ�����£��μ�3�η�̪��Һ����0.1000molL-1��NaOH����Һ�ζ�����ɫ��Ϊ�յ㣬����NaOH����Һ���bmL
������˵����ȷ����___��
A����ȡ��������Ʒ����ʱ���Ƚ���ƿ���ڵ�����ƽ���̵����룬��ʾ�����ȶ�����ȥƤ����������������ٻ�������Ʒ��������Ʒ������ʱ����¼��ȡ��Ʒ������
B��ҡƿʱ��Ӧ����ؽڣ�ʹ��Һ��һ��������Բ���˶���������ʹƿ�ڽӴ��ζ��ܣ���ҺҲ���ý���
C���ζ�ʱ�������ἷѹ��������Һ�����г���״����
D���ζ���������ͣ1��2���ӣ��ȴ��ζ����ڱڹ��е���Һ��ȫ����ʱ�ٶ�ȡ�̶���
E����¼�ⶨ���ʱ���ζ�ǰ���ӿ̶��ߣ��ζ������յ�ʱ�ָ��ӿ̶��ߣ������µζ����ƫ��
�ڼ��㼺���ᴿ�ȵı���ʽΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶���CH3COOH��NH3��H2O�ĵ��볣����ȣ�����10mLŨ��Ϊ0.1mol��L��1��CH3COOH��Һ�еμ���ͬŨ�ȵİ�ˮ���ڵμӹ����У� ��
A.ˮ�ĵ���̶�ʼ������
B.![]() �������ټ�С
�������ټ�С
C.c(CH3COOH)��c(CH3COO��)֮��ʼ�ձ��ֲ���
D.�����백ˮ�����Ϊ10mLʱ��c(NH4+)��c(CH3COO��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�����ͬŨ�ȵ�NaOH��Һ���ֱ�ζ�Ũ�Ⱦ�Ϊ0.1mol��L��1��������(HA��HB��HD)��Һ���ζ���������ͼ��ʾ�������жϴ������( )

A. ������ĵ��볣����ϵ��KHA��KHB��KHD
B. �ζ���P��ʱ����Һ�У�c(B��)��c(Na��)��c(HB)��c(H��)��c(OH��)
C. pH=7ʱ��������Һ�У�c(A��)=c(B��)=c(D��)
D. ���кͰٷ�����100%ʱ����������Һ��Ϻ�c(HA)��c(HB)��c(HD)=c(OH��)��c(H��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��25 ��ʱ��CH3COOH��NH3��H2O�ĵ��볣����ȡ�
��1��25 ��ʱ��ȡ10 mL 0.1 mol��L-1������Һ�����pH��3������Һ��ˮϡ����100 mL����ҺpH��ֵ��ΧΪ___________����Һ��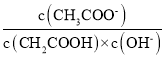 ____����������������С������������������ȷ��������
____����������������С������������������ȷ��������
��2��25 ��ʱ��0.1 mol��L-1��ˮ��NH3��H2O��Һ����pH��______��
��3��ij�¶��£���V1mL 0.1 mol��L-1NaOH��Һ����μ����Ũ�ȵĴ�����Һ����Һ��pOH��pH�ı仯��ϵ��ͼ����֪��pOH��- lgc(OH-)��ͼ��M��Q��N������ʾ��Һ��ˮ�ĵ���̶����ĵ���___________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com