
【题目】实验室制备己二酸的原理为:3![]() +8KMnO4═3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
+8KMnO4═3KOOC(CH2)4COOK+8MnO2↓+2KOH+5H2O
主要实验装置和步骤如下:
①在如图装置中加入5mL10%氢氧化钠溶液和50mL水,搅拌使其溶解,然后加入6.3g高锰酸钾,小心预热溶液到40℃。
②从恒压漏斗中缓慢滴加1.4mL环己醇,控制滴速,使反应温度维持在45℃左右,反应20min后,再在沸水浴上加热5min促使反应完全并使MnO2沉淀凝聚。
③加入适量亚硫酸氢钠固体除去多余高锰酸钾。
④通过___操作,得到沉淀和滤液,洗涤沉淀2~3次,将洗涤液合并入滤液。
⑤加热浓缩使溶液体积减少至10mL左右,趁热小心加入浓硫酸,使溶液呈强酸性(调节pH=1~2),冷却结晶、抽滤、洗涤、干燥,得己二酸白色晶体1.5g。

已知:己二酸的电离平衡常数:Ka1=3.8×10﹣5,Ka2=3.9×10-6;相对分子质量为146;其在水中溶解度如下表
温度(℃) | 15 | 34 | 50 | 70 | 87 | 100 |
己二酸溶解度(g) | 1.44 | 3.08 | 8.46 | 34.1 | 94.8 | 100 |
(1)步骤②中缓慢滴加环己醇的原因是___。
(2)步骤④划线部分操作是___、在第④、⑤布中均要求洗涤沉淀,所用洗涤液依次为___、___。
(3)步骤⑤加入浓硫酸调节pH成强酸性的原因是___。
(4)己二酸产品的纯度可用酸碱滴定法测定。取样试样ag(准确至0.0001g),置于250mL锥形瓶中,加入50mL除去CO2的热蒸馏水,摇动使试样完全溶解,冷却至室温,滴加3滴酚酞溶液,用0.1000molL-1的NaOH标准溶液滴定至微红色即为终点,消耗NaOH标准溶液体积bmL
①下列说法正确的是___。
A.称取己二酸样品质量时,先将锥形瓶放在电子天平秤盘的中央,显示数字稳定后按“去皮”键(归零键),再缓慢加样品至所需样品的质量时,记录称取样品的质量
B.摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出
C.滴定时左手轻轻挤压玻璃球让液体自行呈线状流下
D.滴定结束后稍停1﹣2分钟,等待滴定管内壁挂有的溶液完全流下时再读取刻度数
E.记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,将导致滴定结果偏高
②计算己二酸纯度的表达式为___。
【答案】趁热过滤 防止反应过于剧烈,引发安全问题 趁热过滤 热水 冷水 使己二酸盐转化为己二酸,易析出,浓硫酸不会使浓溶液稀释,可提高己二酸的产率 ABD ![]() %
%
【解析】
由题意可知,三颈烧瓶中加入5mL10%氢氧化钠溶液和50mL水,搅拌使其溶解,然后加入6.3g高锰酸钾,小心预热溶液到40℃,缓慢滴加1.4mL环己醇,控制滴速,使反应温度维持在45℃左右,反应20min后,再在沸水浴上加热5min促使反应完全并使MnO2沉淀凝聚,加入适量亚硫酸氢钠固体除去多余高锰酸钾,趁热过滤得到MnO2沉淀和含有己二酸钾的滤液,用热水洗涤MnO2沉淀,将洗涤液合并入滤液,热浓缩使滤液体积减少至10mL左右,趁热小心加入浓硫酸,使溶液呈强酸性(调节pH=1~2),冷却结晶、抽滤、洗涤、干燥,得己二酸白色晶体,据此分析解答。
(1)如果滴加环己醇速率过快会导致其浓度过大,化学反应速率过快,故为了防止反应过于剧烈,引发安全问题,要缓慢滴加环己醇;故答案为:防止反应过于剧烈,引发安全问题;
(2)根据步骤中“沸水浴上加热5min促使反应完全并使MnO2沉淀凝聚”,说明温度高时,MnO2沉淀的溶解度小,故为了充分分离MnO2沉淀和滤液,应趁热过滤;为减少MnO2沉淀的损失,洗涤时也要用热水洗涤,根据表可知己二酸的溶解度随温度升高而增大,故步骤⑤中洗涤己二酸晶体时应用冷水洗涤,减小己二酸的溶解度,提高产率;故答案为:趁热过滤;热水;冷水;
(3)实验制得的为己二酸钾,根据强酸制弱酸,用浓硫酸调节pH成强酸性可以使己二酸盐转化为己二酸,易于析出,同时浓硫酸不会使浓溶液稀释,可提高己二酸的产率;故答案为:使己二酸盐转化为己二酸,易于析出,同时浓硫酸不会使浓溶液稀释,可提高己二酸的产率;
(4)①A.称取己二酸样品质量时,先将锥形瓶放在电子天平秤盘的中央,显示数字稳定后按“去皮”键(归零键),再缓慢加样品至所需样品的质量时,记录称取样品的质量,A正确;
B.摇瓶时,应微动腕关节,使溶液向一个方向做圆周运动,但是勿使瓶口接触滴定管,溶液也不得溅出,避免待测物质的损失,B正确;
C.滴定时左手轻轻挤压玻璃球让液体自行呈线状流下,容易使标准液滴加过量,应逐滴加入,便于控制实验,C错误;
D.为减少误差,滴定结束后稍停1﹣2分钟,等待滴定管内壁挂有的溶液完全流下时再读取刻度数,D正确;
E.记录测定结果时,滴定前仰视刻度线,滴定到达终点时又俯视刻度线,标准液的消耗读数偏小,将导致滴定结果偏低,E错误;故答案为:ABD;
②一个己二酸分子中含有两个羧基,与NaOH溶液的反应为:HOOC(CH2)4COOH+2NaOH=NaOOC(CH2)4COONa+2H2O,则n(己二酸)=![]() n(NaOH)=
n(NaOH)=![]() ×0.1000mol/L×b×10﹣3L,则己二酸的纯度为:
×0.1000mol/L×b×10﹣3L,则己二酸的纯度为: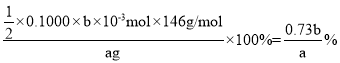 ;故答案为:
;故答案为:![]() 。
。


 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案科目:高中化学 来源: 题型:
【题目】下列对化学用语的理解正确的是( )
A.乙烯的结构简式:CH2CH2
B.电子式![]() 可以表示氢氧根离子,也可以表示羟基
可以表示氢氧根离子,也可以表示羟基
C.比例模型![]() 可以表示甲烷分子,也可以表示四氯化碳分子
可以表示甲烷分子,也可以表示四氯化碳分子
D.结构示意图![]() 可以表示35Cl-,也可以表示37Cl-
可以表示35Cl-,也可以表示37Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氯酸钠(NaClO3)等为原料制备亚氯酸钠(NaClO2)的工艺流程如下,下列说法中,不正确的是
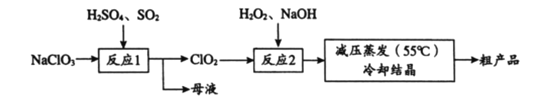
A. 反应1中,每生成1 mol ClO2有0.5 mol SO2被氧化
B. 从母液中可以提取Na2SO4
C. 反应2中,H2O2做氧化剂
D. 采用减压蒸发可能是为了防止NaClO2受热分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确称取6.0 g铝土矿样品(主要成分为Al2O3,含Fe2O3杂质),加入100 mL稀硫酸中,充分反应后向滤液中加入10 mol·L-1NaOH溶液,产生沉淀的质量和加入NaOH溶液体积之间的关系如图所示。则所用硫酸物质的量浓度为( )

A. 3.50 mol·L-1
B. 1.75 mol·L-1
C. 0.85 mol·L-1
D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可利用CO2来制备清洁液体颜料甲醇,有关化学反应如下:
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H1=﹣49.6kJmol-1
反应Ⅱ:CO2(g)+H2(g)H2O(g)+CO(g) △H2=+41kJmol-1
(1)反应Ⅰ在___(填“低温”或“高温”)下可自发反应。
(2)有利于提高上述反应甲醇平衡产率的条件是___。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)在Cu﹣ZnO/ZrO2催化下,CO2和H2混合气体,体积比1:3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①下列说法正确的是___。
A.压强可影响产物的选择性
B.CO2平衡转化率随温度升高先增大后减小
C.由图1可知,反应的最佳温度为220℃左右
D.及时分离出甲醇和水以及使氢气和二氧化碳循环使用,可提高原料利用率
②250℃时,反应Ⅰ和Ⅱ达到平衡,平衡时容器体积为VL,CO2转化率为25%,CH3OH和CO选择性均为50%,则该温度下反应Ⅱ的平衡常数为___。
③分析图2中CO选择性下降的原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室如图的装置模拟工业过程制取硫代硫酸钠(夹持仪器和加热仪器均省略)。其反应原理为2Na2S+Na2CO3+4SO2![]() 3Na2S2O3+CO2
3Na2S2O3+CO2

请回答:
(1)下列说法不正确的是___。
A.装置A的烧瓶中的试剂应是Na2SO3固体
B.提高C处水浴加热的温度,能加快反应速率,同时也能增大原料的利用率
C.装置E的主要作用是吸收CO2尾气
D.装置B的作用之一是观察SO2的生成速率,该处锥形瓶中可选用浓硫酸或饱和NaHSO3溶液
(2)反应结束后C中溶液中会含有少量Na2SO4杂质,请解释其生成原因___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() 的
的![]() ,下列说法正确的是
,下列说法正确的是
A.升高温度,正向反应速率增加,逆向反应速率减小
B.达到平衡后,升温或增大压强都有利于该反应平衡正向移动
C.升高温度有利于反应速率增加,从而缩短达到平衡的时间
D.达到平衡后,降温或减小压强都有利于该反应平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能,此时硫酸铅电极处生成Pb。下列有关说法正确的是
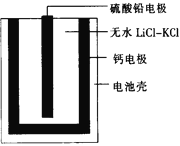
A. 输出电能时,外电路中的电子由硫酸铅电极流向钙电极
B. 放电时电解质LiCl-KCl中的Li+向钙电极区迁移
C. 电池总反应为Ca+PbSO4+2LiCl![]() Pb+Li2SO4+CaCl2
Pb+Li2SO4+CaCl2
D. 每转移0.2 mol电子,理论上消耗42.5 g LiCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素(用字母x等表示)化合价与原子序数的关系图。

根据判断出的元素回答问题:
(1)h在周期表中的位置是__________。
(2)比较z、f、g、r常见离子的半径大小(用化学式表示,下同):______>______>______>______;比较r、m的最高价氧化物对应水化物的酸性强弱:______>______>;比较d、m的氢化物的沸点:______>______。
(3)x与氢元素能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)______,实验室制取该物质的化学方程式为:____________________________________。
(4)由y、m和氢元素组成一种离子化合物,写出其电子式:___________________________。
(5)用铅蓄电池作电源,惰性电极电解饱和em溶液,则电解反应的生成物为(写化学式)___________________________。铅蓄电池放电时正极反应式为式)___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com